Электродный потенциал. Стандартный электродный потенциал. Ряд стандартных электродных потенциалов
Между положительными ионами и электронами возникает скачок потенциала, который называется электродным потенциалом. Потенциал, возникающий в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Значение электродного потенциала, возникающего на границе металл-раствор, зависит от природы металла, активности ионов этого металла и от температуры.
Абсолютное значение электродного потенциала в настоящее время измерить или рассчитать невозможно. Но можно определить значение электродного потенциала относительно какого-либо электрода, выбранного в качестве стандарта. Согласно международному соглашению таким стандартом служит стандартный (нормальный) водородный электрод, потенциал которого условно принят за нуль:  = 0.0 В.
= 0.0 В.
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью и опущенную в раствор Н2SO4 или HCI с  = 1 моль/л, через который все время пропускается газообразный Н2 под давлением 101.3 кПа при 298 К (рис. 2).
= 1 моль/л, через который все время пропускается газообразный Н2 под давлением 101.3 кПа при 298 К (рис. 2).
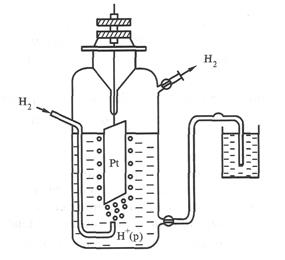
Рис. 2. Схема водородного электрода
Платина, отличающаяся высокой химической стойкостью, в электродном процессе не участвует. Ее роль сводится к адсорбции на своей поверхности водорода и переносу электронов. На поверхности платины протекает процесс:
H2 ⇄ 2Н+ + 2 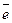
Если пластинку любого металла соединить со стандартным водородным электродом, то получим значение стандартного электродного потенциала данного металла.
Располагая металлы в порядке увеличения стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов. Металлы, стоящие в ряду напряжений после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом осуществляется только в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого. Чем дальше друг от друга удалены металлы в электрохимическом ряду напряжений (то есть чем больше разница между стандартными потенциалами металлов), тем больше электродвижущая сила (ЭДС) гальванического элемента, в котором эти металлы использованы.
Стандартные потенциалы являются количественной мерой окислительно-восстановительной способности системы. Чем выше значение φ0, тем большей окислительной способностью обладает окисленная форма данной пары. Восстановительные свойства сильнее выражены у восстановленной формы в паре с меньшим значением φ0.
Все металлы в ряду напряжений делятся на: активные (литий – алюминий), средней активности (после алюминия и до водорода), неактивные (с φ0 > 0).
Дата добавления: 2014-12-05; просмотров: 1884;
