При составлении уравнений окислительно-восстановительных реакций в основном используют 2 метода: метод электронного баланса и метод электронно-ионного баланса.
Метод электронного баланса реализуется в несколько стадий:
1) установление формул исходных веществ и продуктов реакции;
2) определение степеней окисления элементов в реагентах и продуктах реакции;
3) определение числа электронов, отданных восстановителем и принятых окислителем;
4) определение коэффициентов перед формулами реагентов и продуктов реакции.
Метод электронно-ионного баланса более универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, особенно протекающих с участием органических соединений, в которых процедура определения степеней окисления является очень сложной. Составление уравнений этим методом осуществляется через ряд стадий:
1) определение окислителя и восстановителя, а также продуктов окисления и восстановления;
2) составление ионно-молекулярных уравнений полуреакций (окисления и восстановления) с учетом электронов;
3) определение на основе требования электронного баланса коэффициентов перед строками уравнений полуреакций;
4) суммирование левых и правых частей уравнений полуреакций и составление на этой основе уравнения окислительно-восстановительной реакции в ионно-молекулярной форме;
5) переход от ионно-молекулярной формы окислительно-восстановительной реакции к молекулярной.
При реализации этой последовательности необходимо придерживаться ряда правил. К ним относятся:
1) Участники реакции (реагенты и продукты) записываются в уравнениях полуреакций в той форме, в которой они присутствуют в растворе. Например, если в качестве окислителя используется сильный электролит дихромат калия, то в качестве окислителя в уравнении полуреакции записывают анион Cr2O72-, реально присутствующий в растворе и осуществляющий функцию окисления. В то же время восстановитель, сульфид железа (II) FeS, записывается в молекулярной форме, поскольку он нерастворим и практически не диссоциирует на ионы. То же самое справедливо для газообразных участников реакции.
2) Если между реагентами и продуктами в уравнениях полуреакций происходит перераспределение кислорода, то для осуществления такого перераспределения используется:
– в кислой среде пара H+ – H2O;
– в нейтральной среде пары H2O – H+ , H2O – OH– ;
– в щелочной среде пара OH– – H2O.
При этом в случае нейтральной среды в левой части уравнений полуреакций всегда должна фигурировать вода.
3) В уравнениях полуреакций помимо баланса элементов должен соблюдаться зарядовый баланс, который устанавливается путем прибавления к левой части уравнения или вычитания из нее соответствующего количества электронов.
4) При переходе от ионно-молекулярной к молекулярной форме уравнения следует иметь в виду, что добавление в левую часть уравнения новых частиц (например, к дихромат-аниону Cr2O72– добавляют стехиометрическое количество противоионов К+ или Na+), эти частицы должны быть перенесены и в правую часть.
Принципиальная возможность осуществления окислительно-восстановительных реакций в стандартных условиях выявляется на основе разности электродных потенциалов окислителя и восстановителя
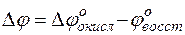 (1)
(1)
связанной с изменением энергии Гиббса соотношением
DG=–nF 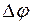 (2)
(2)
Из последнего выражения следует, что процесс принципиально осуществим при 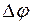 >0 (D G < 0) и наоборот, процесс невозможен при
>0 (D G < 0) и наоборот, процесс невозможен при 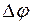 < 0 (D G > 0).
< 0 (D G > 0).
Дата добавления: 2014-12-05; просмотров: 1727;
