Примеры решения типовых задач. Пример 1. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Пример 1. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Задача 1. Составьте уравнение окислительно-восстановительной реакции окисления дисульфида серы (II) кислородом.
Решение. Продуктами этой реакции являются SO2 и Fe2O3. Соответственно степень окисления железа изменяется от +2 до +3, степень окисления серы – от –1 до +4, степень окисления кислорода – от 0 до –2. Можно видеть, что функцию восстановителя в этой реакции выполняют совместно Fe2+ и S22-, функцию окислителя – О2. В этой связи представим реакции окисления и восстановления схемой:
| 11 | О2 + 4е 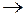 2 О2- 2 О2-
| восстановление, окислитель О2 |
| 4 | Fe2+ – 1е 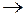 Fe3+
S22- – 10е Fe3+
S22- – 10е 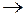 2 S4+ 2 S4+
| окисление, восстановитель FeS2 |
4 FeS2 + 11О2 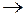 2 Fe2O3 + 8 SO2
2 Fe2O3 + 8 SO2
По числу принятых кислородом и отданных FeS2 электронов определяем коэффициенты перед окислителем и восстановителем. С учетом поэлементного баланса находим коэффициенты перед формулами продуктов реакции.
Пример 2. Составление уравнений окислительно-восстановительных реакций методом электронно-ионного баланса.
Дата добавления: 2014-12-05; просмотров: 1240;
