Задача 1. Составьте уравнение окислительно-восстановительной реакции между перманганатом калия и сульфитом натрия в среде серной кислоты.
Решение. KMnO4 и Na2SO3 – сильные электролиты, поэтому в растворе они практически полностью диссоциируют на ионы. Окисляющим началом является анион MnO4– , в котором марганец находится в степени окисления +7. В то же время у серы в сульфит-анионе имеется ресурс окисления до сульфат-аниона, поэтому он является восстановителем. Известно, что в кислой среде перманганат-анион восстанавливается до Mn2+. Поэтому уравнения полуреакций записываются в виде:
| 2 | MnO4 –+ 8Н+ + 5е 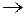 Mn2+ + 4 Н2О Mn2+ + 4 Н2О
| восстановление, окислитель KMnO4 |
| 5 | SО32– + Н2О – 2е 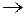 SО42– + 2Н+ SО42– + 2Н+
| окисление, восстановитель Na2SO3 |
2MnO4 – + 16Н+ + 5SО32– +5Н2О 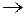 2Mn2+ + 8 Н2О + 5SО42– + 10Н+
2Mn2+ + 8 Н2О + 5SО42– + 10Н+
Можно видеть, как пара Н+ – Н2О осуществляет перераспределение кислорода между реагентами и продуктами реакции.
Коэффициенты перед строками уравнений полуреакций отражают требования электронного баланса: количество электронов, принятых окислителем должно быть равно количеству электронов, отданных восстановителем. Суммирование левых и правых частей уравнений реакций с учетом умножения их на указанные коэффициенты дает уравнение окислительно-восстановительной реакции в ионно-молекулярной форме, приведенное под чертой. Сокращение подобных членов в этом уравнении приводит к более компактной его форме
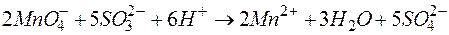
Переход к молекулярной форме приводит к окончательному виду уравнения: 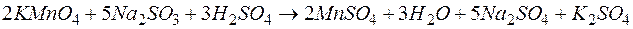 .
.
Пример 3. Составление уравнений окислительно-восстановительных реакций, протекающих в нейтральной среде.
Задача 1. Составьте уравнение окислительно-восстановительной реакции между сульфатом марганца(II) и перманганатом калия.
Решение. Продуктомэтой реакции является MnO2, следовательно, в роли окислителя выступает анион 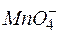 , а восстановителя –
, а восстановителя – 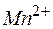 . Составляем уравнение полуреакции, учитывая, что в левой части этих уравнений в качестве перераспределителя кислорода выступает вода.
. Составляем уравнение полуреакции, учитывая, что в левой части этих уравнений в качестве перераспределителя кислорода выступает вода.
| 2 | MnO4 –+ 2Н2О + 3е 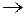 MnО2 + 4ОН – MnО2 + 4ОН –
| восстановление, окислитель MnO4– |
| 3 | Mn2+ + 2Н2О – 2е 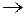 MnО2 + 4Н+ MnО2 + 4Н+
| окисление, восстановитель Mn2+ |
2MnO4 – + 10Н2О + 3Mn2+ 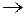 5MnО2 + 8ОН – + 12Н+.
5MnО2 + 8ОН – + 12Н+.
Суммирование левых и правых частей уравнений полуреакций с учетом умножения их строк на приведенные коэффициенты дает ионно-молекулярное уравнение, представленное под чертой. С учетом того, что рекомбинация 8Н + и 8ОН – в правой части этого уравнения дает 8 молекул воды, сокращаем воду в левой и правой частях и получаем уравнение
2MnO4 – + 2Н2О + 3Mn2+ 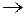 5MnО2 + 4Н+.
5MnО2 + 4Н+.
Переход к молекулярной форме приводит к окончательному виду уравнения:
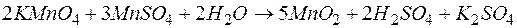 .
.
Пример 4. Составление уравнений окислительно-восстановительных реакций с участием органических соединений.
Задача 1. Составьте уравнение реакции окисления этилбензола перманганатом калия в нейтральной среде.
Решение. Роль окислителя в этой реакции выполняет перманганат-анион, а восстановителя – этилбензол, 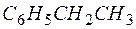 . В нейтральной среде перманганат-анион переходит в
. В нейтральной среде перманганат-анион переходит в  , а этилбензол деструктивно окисляется до бензойной кислоты и углекислого газа. В этой связи уравнение полуреакций записывается в виде
, а этилбензол деструктивно окисляется до бензойной кислоты и углекислого газа. В этой связи уравнение полуреакций записывается в виде
| 4 | MnO4 –+ 2Н2О + 3е  MnО2 + 4ОН – MnО2 + 4ОН –
| восстановление, окислитель MnO4– |
| 1 | 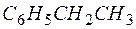 + 4Н2О – 12е + 4Н2О – 12е 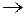 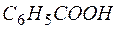 + + 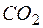 + 12Н+ + 12Н+
| окисление, восстановитель
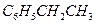
|
4MnO4 – + 12Н2О + 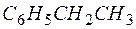
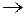 4MnО2 +
4MnО2 + 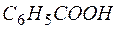 +
+ 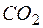 + + 12 Н2О + 4ОН –
+ + 12 Н2О + 4ОН –
Сокращая воду в левой и правой частях полученного уравнения и учитывая взаимодействия
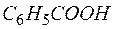 + ОН –
+ ОН – 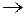
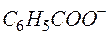 + Н2О
+ Н2О
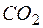 + 2ОН –
+ 2ОН – 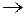
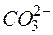 + Н2О,
+ Н2О,
приходим к уравнению
4MnO4 – + 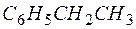
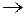 4MnО2 +
4MnО2 + 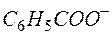 +
+ 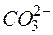 +2Н2О+ ОН-
+2Н2О+ ОН-
Переходим к молекулярной форме уравнения:
4КМnO4 + 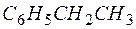
 4MnО2 +
4MnО2 + 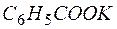 +
+ 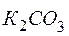 +2Н2О+ + КОН.
+2Н2О+ + КОН.
Пример 5.Определение окислительно-восстановительных молярных масс эквивалентов.
Задача 1. Чему равен эквивалент окислителя в реакции 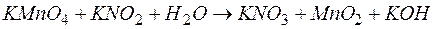 ?
?
Решение. Молярная масса эквивалента окислителя (восстановителя) равна его молярной массе, деленной на число принятых (или отданных) электронов. В приведенной реакции окислителем является 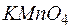 (Мr=158, М=158г/моль), а процесс восстановления идет по схеме
(Мr=158, М=158г/моль), а процесс восстановления идет по схеме 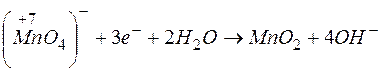 .
.
Следовательно, молярная масса эквивалента окислителя равна
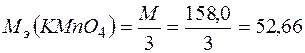 (г/моль).
(г/моль).
Пример 6.Определение направления окислительно-восстановительной реакции по величине окислительно-восстановительных потенциалов (Red-Ox-потенциалов).
Задача 1. Возможно ли в качестве окислителя в кислой среде использовать 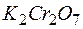 в следующих процессах при стандартных условиях:
в следующих процессах при стандартных условиях:
а) 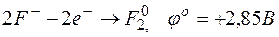 ;
;
б) 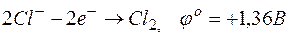 ;
;
в) 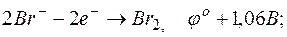
г) 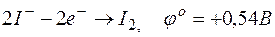 .
.
Стандартный окислительно-восстановительный потенциал системы
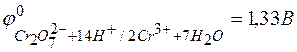 .
.
Решение. Для определения направления окислительно-восстановительной реакции необходимо определить ЭДС ( 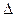 E,
E, 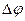 ):
):
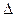
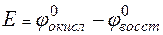 ,
,
где 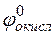 – потенциал окислителя;
– потенциал окислителя; 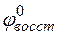 – потенциал восстановителя.
– потенциал восстановителя.
Реакция возможна, если 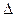 E (
E ( 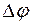 ) >0.
) >0.
Для выяснения возможности протекания окислительно-восстановительных реакций определяем ЭДС следующих систем:
а) 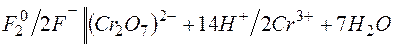
 E=1,33-2,85= -1,52В;
E=1,33-2,85= -1,52В;
б) 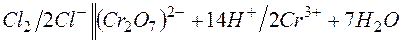
 E =1,33-1,36= -0,03В;
E =1,33-1,36= -0,03В;
в) 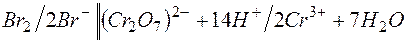
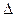 E =1,33-1,06= +0,27В;
E =1,33-1,06= +0,27В;
г) 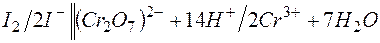
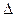 E =1,33-0,54= +0,79В.
E =1,33-0,54= +0,79В.
Таким образом, дихромат калия 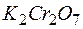 может быть использован в качестве окислителя только для процессов:
может быть использован в качестве окислителя только для процессов:
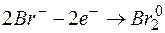
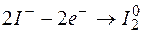 .
.
Пример 7. Определение возможности протекания окислительно-восстановительной реакции по величине изменения энергии Гиббса (изобарно-изотермического потенциала).
Задача 1.Определите возможность протекания окислительно-восстановительной реакции
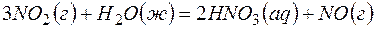 ,
,
если стандартные значения энергии Гиббса равны:
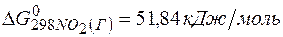 ;
; 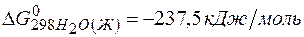 ;
;
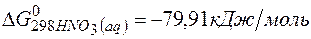 ;
; 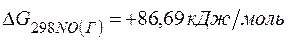 .
.
Решение.Определяем 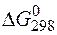 процесса
процесса
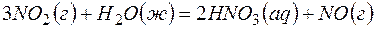 ;
;
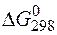 =
= 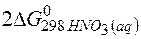 +
+ 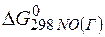 – 3
– 3 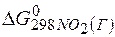 –
– 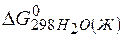 =
=
=2(-79,91) + 86,69 – 3(51,84) – (-237,5)=8,65кДж.
Так как 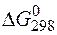 > 0, то протекание данной реакции возможно только в обратном направлении, т.е. справа налево.
> 0, то протекание данной реакции возможно только в обратном направлении, т.е. справа налево.
1.8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимическими процессами называют процессы взаимного превращения химической и электрической форм энергии.
Электрохимические процессы можно разделить на две основные группы:
1)процессы превращения химической энергии в электрическую (в гальванических элементах);
2) процессы превращения электрической энергии в химическую (электролиз).
Простейшая электрохимическая система состоит из двух электродов, соединенных друг с другом металлическим проводником (внешней цепи) и ионного проводника между ними (растворы или расплавы электролитов).
1.8.1. Гальванические элементы
При окислительно-восстановительных реакциях происходит переход электронов от восстановителя к окислителю. Эту реакцию можно проводить таким образом, чтобы процессы окисления и восстановления были пространственно разделены, а электроны перемещались от восстановителя к окислителю по внешней цепи.
Устройства, при помощи которых химическая энергия превращается в электрическую, называются гальваническими элементами, или химическими источниками электрической энергии.
Одним из первых гальванических элементов был сконструирован гальванический элемент Якоби-Даниэльса. Это устройство состоит из двух электродов - металлических пластин (цинковой и медной), помещённых в раствор электролитов (солей цинка и меди), разделенных пористой перегородкой, и соединённых проводником.
Электрод, на котором протекает процесс окисления, называется анодом.
Электрод, на котором протекает процесс восстановления, называется катодом.
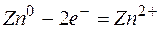 окисление
окисление
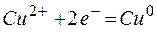 восстановление
восстановление
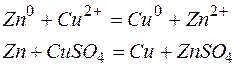
Используют специальную форму записи гальванического элемента, в которой указывают анод, поверхность раздела, первый электролит, электролитический ключ, второй электролит, катод и направление движения электронов во внешней цепи:
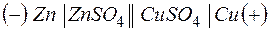
анод катод
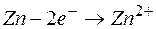
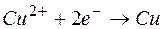
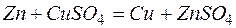
Т.о., цинковая пластина начинает растворяться, а на медной пластине начинает осаждаться медь, пока равновесие не восстановится.
Электрический ток, протекающий по внешней цепи, может совершать полезную работу, которая равна произведению количества прошедшего электричества на напряжение:
Amax = nF∆E,
где: n – число электронов, участвующих в окислительно-восстановительном процессе;
F – число Фарадея (F = 96500 Кл/моль);
DE – электродвижущая сила гальванического элемента (ЭДС).
В то же время максимальная полезная работа равна изменению свободной энергии Гиббса реакции: Amax = - ∆G.
Работа гальванического элемента процесс самопроизвольный (∆G<0).
∆G = - nF∆E
ЭДС гальванического элемента – это максимальное значение напряжения гальванического элемента.
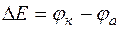 ,
,
где: 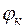 - электродный потенциал катода;
- электродный потенциал катода;
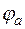 - электродный потенциал анода.
- электродный потенциал анода.
Электродные потенциалы возникают на границе раздела фаз металл – электролит. При погружении металла в раствор, содержащий одноименный ион, начинается сложное взаимодействие металла с компонентами раствора, в результате чего происходит окисление металла, и его гидратированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
М + m H2O 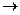 M(H2O)mn+ + ne
M(H2O)mn+ + ne
| - - - Металл - - - - | + + + + + + + + + + Раствор + + + + |
| Рис.1 Строение двойного электрического слоя на границе раздела металл-раствор |
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла, в результате чего на границе металл–раствор возникает двойной электрический слой (рис.1). Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом.
Наряду с окислением металла протекает обратная реакция – восстановления ионов металла до атомов. При некотором значении электродного потенциала, который называется равновесным электродным потенциалом, устанавливается равновесие
М + m H2O 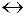 M(H2O)mn+ + ne
M(H2O)mn+ + ne
или без учета гидратационной воды: М 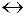 M n+ + ne.
M n+ + ne.
Дата добавления: 2014-12-05; просмотров: 7896;
