Решение. Bа(ОН)2 ® Bа2+ + 2ОН- - сильное основание
Bа(ОН)2 ® Bа2+ + 2ОН- - сильное основание
0,05 2.0,05 моль/л
I =1/2(0,05×22 + 0,1×12) =0,15, gОН- ≈ 0,8 (таблица), аОН-= gОН-×сOH-=0,8×0,1=0,08
рН = 14 + lg аОН- = 14 - 1,1 = 12,9.
ГИДРОЛИЗ СОЛЕЙ
- реакции обмена между молекулами воды и растворенными в ней солями
Признаки гидролиза:
· образование слабого электролита
· изменение нейтральной реакции среды.
Подвергаются гидролизу:
1.Соли,образованные сильными кислотами и слабыми основаниями – гидролиз по катиону (NH4Cl, AgNO3, AlBr3, CuSO4 и т. д.)

 Уравнение диссоциации соли: AgNO3 ® Ag+ + NO3-
Уравнение диссоциации соли: AgNO3 ® Ag+ + NO3-
AgОН HNO3
слабое основание сильная кислота
a <1 a = 1
Уравнение гидролиза: Ag+ + НОН Û AgОН + Н+ кислая среда рН < 7
2. Соли,образованные слабыми кислотами и сильными основаниями - гидролиз по аниону (К2SiO3, Na2S, Ba(СН3СОО)2 и т. д.)
 NaF ® Na+ + F-
NaF ® Na+ + F-

NaOH HF
сильное основание(a = 1) слабая кислота (a <1)
Уравнение гидролиза: F- + HOН Û HF + ОН- основная среда рН > 7
3. Соли,образованные слабым основанием и слабой кислотой (NН4СN, РbCO3, Аl2S3 и т д.)
Уравнение диссоциации соли: NН4СN ® NН4+ + CN-
Гидролиз по аниону и по катиону:
СN- + НОН Û НСN + ОН- по аниону
NН4+ + НОН Û NН4ОН + Н+ по катиону
NН4+ + СN- + Н2О Û NН4ОН + НСN суммарно, рН > 7, т.к. Кд основания= 1,79.10-5 > Кд кислоты = 7,9.10-10.
Среда слабоосновная, если Кд кислоты < Кд основания, среда слабокислая, если Кд кислоты > Кд основания и среда нейтральная, если Кд кислоты = Кд основания.
Если в результате гидролиза образуются малорастворимые или газообразные вещества Þ гидролиз необратимый:
PbCO3 + Н2О ® Pb(ОН)2¯ + CO2
Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются (Na2SO4, KI, NaВr, СsCl, RbNО3 и т. д.)
 Na2SO4 ® Na+ + SO42-
Na2SO4 ® Na+ + SO42-

NaOH H2SO4
сильное основание сильная кислота раствор нейтральный: рН » 7.
Гидролиз многозарядных ионов протекает ступенчато (FeCl3):
Fe3+ + НОН Û FeОН2+ + Н+ - 1-я ступень;
FeОН2+ + НОН Û Fe(ОН)2+ + Н+ - 2-я ступень;
Fe(ОН)2+ + НОН Û Fe(ОН)3 + Н+ - 3-я ступень
При комнатных температурах гидролиз идет преимущественно по 1-ой ступени.
Смещение гидролитического равновесия в сторону усиления гидролиза
· разбавление (увеличение концентрации Н2О),
· повышение температуры (эндотермическая реакция ΔНГ>0)
· удаление продуктов гидролиза из сферы реакции (связывание ионов Н+ и ОН-)
Количественные характеристики гидролиза:
· Константа гидролиза КГ – константа гидролитического равновесия.
Для процесса: Ag+ + HOH ÛAgOH + H+ кислая среда рН< 7

- константа равновесия (для разбавленных растворов а =с)
КССНОН = const = КГ - константа гидролиза  - выражение для Кг .
- выражение для Кг .
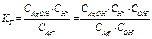 ; (СН+.СОН- = Кв и
; (СН+.СОН- = Кв и 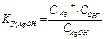 AgOH Û Ag+ + OH-)
AgOH Û Ag+ + OH-)
 - константа гидролиза.
- константа гидролиза.
Na2S →2 Na++S2-
1cт.: S2- + HOН Û HS- + ОН- основная среда
2ст.: HS- + HOН Û H2S + ОН- рН > 7
H2S Û H+ + HS- КД1 HS- ÛH+ + S2- КД2

КГ(1ст)=10-14/10-14=1
 КГ(2ст)=10-14/1,1.10-7= =9,1.10-8
КГ(2ст)=10-14/1,1.10-7= =9,1.10-8
КГ(1ст) > КГ(2ст)
Если соль образована слабым основанием и слабой кислотой, то КГ = КВ/(КД кислоты.КД основания)
где КДк и КДо - константы диссоциации слабой кислоты и слабого основания - продуктов гидролиза.
Степень гидролиза b: отношение концентрации гидролизованных ионов соли к исходной концентрации ионов, подвергающихся гидролизу
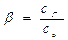
b < 1
где сГ - равновесная концентрация гидролизованных ионов;
с0 - исходная концентрация ионов соли, подвергающихся гидролизу.
Связь степени гидролиза b с константой гидролиза КГ (аналогично закону Оствальда ): КГ = b2×с0/(1 - b)
Если b << 1, то КГ » b2×с0 и b »  . (когда КГ< 10-4 )
. (когда КГ< 10-4 )
· Вывод: с уменьшением концентрации гидролизующейся соли степень гидролиза (то есть глубина его протекания) увеличивается.
· Константа гидролиза (как и любая константа равновесия) зависит: от природы реагентов и от температуры: т.к. гидролиз - процесс эндотермический (DНГ >0), при ↑Т КГ ↑, выход продуктов гидролиза↑
Расчет рН растворов солей с гидролизом по аниону:
Дата добавления: 2014-12-03; просмотров: 1178;
