Задача 17. Определите осмотическое давление 0, 105 М водного раствора 1,3-пропандиола НОС3Н6ОН (Росм) при Т = 20 ºС
Определите осмотическое давление 0, 105 М водного раствора 1,3-пропандиола НОС3Н6ОН (Росм) при Т = 20 ºС, если .
Решение
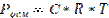
R - универсальная газовая постоянная, 8,314 Дж/(моль*К)
Т - температура, К. Т=t+273=273+20=293 К
Молярная концентрация С=0,105 моль/л
Тогда: 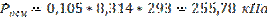
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- растворы, содержащие в заметных концентрациях заряженные частицы, образующиеся в результате электролитической диссоциации растворенного вещества.
Электролитическая диссоциация – процесс образования ионов (Аррениус 1886 г).
Растворение молекулярных веществ:
а) образование сольватированной молекулы:
АВ+(n+m)S Û AB(n+m)S (а)
АВ - растворяемое вещество; S - полярные молекулы растворителя
АВ(n + m)S - сольватированная молекула (сольват).
б) сольват диссоциирует на сольватированные ионы:
АВ(n + m)S Û Аq+nS + Bq-mS (б)
Процесс сольватации может остановиться на любой стадии.
· только стадия (а) - раствор неэлектролита. Ионов в растворе нет, ионной проводимости нет.
(раствор кислорода и сахара в воде, бензола в толуоле)
· стадии (а) и (б) - раствор электролита. Идет электролитическая диссоциация с образованием ионов.
Уравнения электролитической диссоциации (опуская промежуточные стадии, указав лишь начальные и конечные продукты реакции): АВ + (n + m)S Û Аq+nS + Вq-mS
(диссоциация муравьиной кислоты в воде HСООН + (n + m)Н2О Û HСОО- nН2О + Н+ mН2О;
обычно записывают: НСООН Û НСОО- + Н+
n и m - стехиометрический состав сольватов, не постоянен, зависит от концентрации, температуры и других параметров раствора).
При растворении ионного соединения стадии (а) и (б) -образования сольватов и электролитическая диссоциация совмещены и могут протекать практически необратимо:
Аq+Вq- + (n + m)S ® Аq+nS + Bq-mSили Аq+Вq- ® Аq+ + Bq-
(диссоциация хлористого натрия в воде NaCl ® Na+ + Cl-)
Примеры электролитов: растворы щелочей, солей и ряда неорганических кислот в воде, растворы ряда солей в жидком аммиаке, ацетонитриле и др. органических растворителях.
Наиболее часто растворы электролитов классифицируют по степени диссоциации a: a = сдис / со - отношение числа молекул, диссоциированных на ионы сдис, к общему числу молекул растворенного электролита с0 (исходной концентрация электролита).
Классификация веществ по степени диссоциации:
a = 0 – неэлектролиты, сдис= 0
a = 1 – сильные электролиты сдис= с0
a < 1 - слабые электролиты сдис < с0
a- зависит от:
1. Природы растворенного вещества: a(НF) < a(НСl)
2. Природы растворителя: чем e↑, тем легче рвется связь под действием полярных молекул растворителя и a вышеe (Н2О) = 81 e (С6Н6) = 2
3. Температуры: зависимость определяется тепловым эффектом (при DН0дис˂0a уменьшается, а при DН0дис˃0 a увеличивается с ростом Т)
4. Концентрации раствора: с ↑концентрации a уменьшается.
5. При введении одноименного иона (СН3СООNH4→СН3СОО- + NH4+) равновесие диссоциации уксусной кислоты смещается влево и a уменьшается СН3СООН Û СН3СОО- + Н+.

Водные растворы электролитов
Слабые электролиты (a < 1)
слабые электролиты – вода, водные растворы многих неорганических и органических кислот, оснований р-, d- и f-элементов
Для расчета используют основные положения теории Аррениуса: к обратимому процессу диссоциации может быть применен закон действующих масс. Константа равновесия КС называется константой диссоциации.
Чем меньше КД в данном растворителе, тем слабее диссоциирует электролит.
Для процесса диссоциации слабой кислотыНА Û Н+ + А-
константа диссоциации кислоты Кд 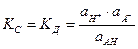
g ≈1 (взаимодействие слабое) Þ а =g ×с = с Þ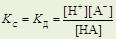
где [H+] – равновесная концентрация Н+
Для процесса диссоциации слабого основанияRОН Û R+ + ОН-
константа диссоциации основания Кд 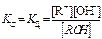
Зависимость a от концентрации слабого электролита
Диссоциация муравьиной кислоты: НСООН Û НСОО- + Н+.
(1 - a)со aсо aсо
со - исходная концентрация кислоты
a - степень диссоциации,
| НСООН | НСОО- | Н+ | |
| Сисх | со | ||
| DС | aсо | aсо | aсо |
| Сравн | со - aсо | aсо | aсо |
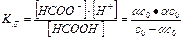 КД = 1,77×10-4 при t = 25° С.
КД = 1,77×10-4 при t = 25° С.
Закон разведения Оствальда:
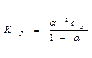 или
или 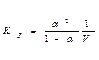 где V= 1/С0 – разведение.
где V= 1/С0 – разведение.
Степень диссоциации 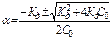
Если a<<1, то КД » a2со -приближенная формула закона Оствальда,тогда 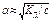 для расчетов с Кд < 10-4.
для расчетов с Кд < 10-4.
ВЫВОД: a уменьшается с увеличением концентрации.
Многоосновные слабые кислоты (H2SO3, H2CO3 и т.д.) и многокислотные основания (Zn(OH)2, Al(OH)3 и т.д.) диссоциируют ступенчато:
1-ая ступень Zn(ОН)2 Û ZnОН+ + ОН- КД1 = 4,4×10-5.
2-ая ступень ZnОН+ Û Zn2+ + ОН- КД2 = 1,5×10-9.
· Константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем предыдущей: КД2 << КД1
· КД зависит
- от природы диссоциирующего вещества и растворителя (чем меньше КД, тем устойчивее частица),
- от температуры: с Т↑обычно КД↓ (∆Н < 0 )
· КД не зависит от концентрации раствора.
· величины КД –табулированы при 250 С.
Сильные электролиты (a = 1)
В водных растворах сильные электролиты -почти все соли, щелочи (гидроксиды s-металлов, кроме Be(OH)2 Mg(OH)2), кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4…
Сильные электролиты диссоциируют полностью, необратимо(нет нераспавшихся частиц):
Ba(OH)2 ® Ba2+ + 2OH-
Al2(SO4)3 ® 2Al3+ + 3SО42-
Þсионов большая Þ свойства растворов зависят от взаимодействия ионов друг с другом и с Н2О. g ≠ 1
П.Дебай и Э.Хюккель (1923г.) – понятие ионной атмосферы: каждый ион окружен противоположно заряженными ионами, каждый ион - центр своей ионной атмосферы; в очень концентрированных растворах – ионные пары
При расчете растворов сильных электролитов все основные параметры раствора выражают какфункцию суммарного взаимодействия атмосфер с центральными ионами.Энергия этого взаимодействия ↑ при ↑ С и при ↓ Rатм и при ↑плотности заряда атмосферы. В расчетах вместо С используют активность а =g×с
g± - средний коэффициент активности электролита(определяют экспериментально).
Для электролита АnВm → nАm+ + mВn-
g± = среднее геометрическое коэффициентов активности образующих его ионов: 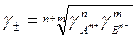
Средний коэффициент активности электролита g± зависит от природы растворителя и вещества, концентрации, Т
В разбавленных растворах (С<0,1) gi зависит от концентрации и заряда ионов.
Правило ионной силы:
ионы с одинаковой абсолютной величиной заряда в разбавленных растворах сильных электролитов с одинаковой ионной силой имеют равные коэффициенты активности.
Ионная сила раствора I -количественная характеристика межионного взаимодействия: I = 0,5×å (сi ××z2i)
где ci – концентрация i -иона
zi - заряд i -иона
Коэффициенты активности отдельных ионовgiопределяют приближенно:
1.По правилу ионной силы, используя справочник для 0,001< I < 0,1
(gI = f(I) - справочная величина)
| Ионы | Коэффициент активности для ионной силы | |||||
| 0,001 | 0,01 | 0,02 | 0,05 | 0,07 | 0,1 | |
| Водорода Однозарядные Двухзарядные Трёхзарядные | 0,98 0,98 0,77 0,73 | 0,92 0,92 0,58 0,47 | 0.90 0,89 0,50 0,37 | 0,88 0,85 0,50 0,37 | 0,86 0,83 0,36 0,25 | 0,84 0,80 0,30 0,21 |
2.По формулам Дебая-Гюккеля для водных растворов:
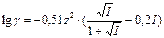 (для I » 10)
(для I » 10) 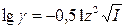 (для I £ 0,01)
(для I £ 0,01)
 Коэффициенты активности отдельных ионов gi:
Коэффициенты активности отдельных ионов gi:
ü в области высококонцентрированных растворов gi=1 и больше.
ü в области очень разбавленных растворов gi → 1
ü в области разбавленных растворов (ниже 0,1 моль/л) g зависят от концентрации и заряда ионов и мало зависят от природырастворенных веществ.
Дата добавления: 2014-12-03; просмотров: 792;
