ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Вода - очень слабый электролит: Н2О + Н2О Û Н3О+ + ОН- (самоионизация) Н2О Û Н+ + ОН- DH0298дисс=55,9 кДж; DS0298дисс =-80,48 Дж/К
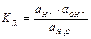 =1,8×10-16 при 25оС
=1,8×10-16 при 25оС
ɑН2О = const = 1000/18 ≈ 55,5моль/л Кд • ɑН2О = const= КВ (при T= const)
Ионное произведение Н2О: 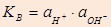 ;
;
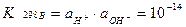 (*)KВ 398 = 6,2×10-13
(*)KВ 398 = 6,2×10-13
КВ растет с ростом температуры, т.к. DH0диссН2О >0
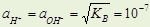 при комнатной Т в нейтральной среде
при комнатной Т в нейтральной среде
Ионы Н+ - носители кислотных свойств, а ОН- - основных свойств.
Прологарифмируем: lgKВ = lgaH+ + lgaOH- = -14
-lgaH+ = рН -водородный показатель; -lgaOH- = рОН - показатель ионов ОН-
логарифмическая форма ионного произведения Н2О: рН + рОН = 14(298К)
при 298 К
| среда | сН+,моль/л | сОН-,моль/л | рН |
| нейтральная сН=сон | 10-7 | 10-7 | |
| кислая сН>сон | >10-7 | <10-7 | <7 |
| щелочная сН<сон | <10-7 | >10-7 | >7 |
Индикаторы – вещества изменяющие свою окраску при изменении рН (IndOH – либо HInd)
Метилоранж HInd Û H+ + Ind-
красный вкислой среде в щелочной среде желтый
Современный способ измерения рН – рН-метрия
Дата добавления: 2014-12-03; просмотров: 618;
