Задача 21.
Рассчитать КГ, b и рН раствора К2SО3 С0 = 0,01моль/л
Решение. Диссоциация сильного электролита К2SО3:
2со со
К2SО3 ® 2К+ + SО32-
 | 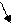 | ||
КОН Н2SО3
сильное основание слабая кислота
Гидролиз по SО32-:
1-ая ступень: SО32-+ НОН Û НSО3-+ ОН-
КГ1 = 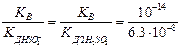 = 1,59×10-7
= 1,59×10-7
2-ая ступень: НSО3- + Н2О Û Н2SО3 + ОН-
КГ2 =  = 5,9×10-13 КГ1 > >КГ2
= 5,9×10-13 КГ1 > >КГ2
1-й способ – через материальный баланс
| SO32- | НSO3- | OН- | |
| cисход | со | ||
| Dc | x | x | x |
| cравн | со - x | x | x |
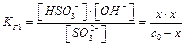 (*) Þx=[ОН-] Þ pOH Þ pH
(*) Þx=[ОН-] Þ pOH Þ pH
x = [ОН-] = 4×10-5 моль/л; pOH = -lg[ОН-] = 4,4; pH = 14 -4,4 = 9,6
Обратная задача:
Зная рН раствора соли рН = 9,6 рассчитать концентрацию соли в растворе c0.
Алгоритм решения: pH = 9,6; pOH = 14-рН = 14 – 9,6 = 4,4; [ОН-] = x = 10-рОН =10-4,4; подставив значение х в выражение для КГ ,решаем его относительно неизвестного С0,: 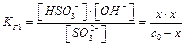 = 1,59×10-7, находим с0 = 0,01моль/л. [SО32-] = c0 = cсоли.
= 1,59×10-7, находим с0 = 0,01моль/л. [SО32-] = c0 = cсоли.
2-й способ – через степень гидролиза
По определению: b = cГ/c0= [OH]/c0 Þ[OH] = b×c0
рН = 14 – рОН = 14 + lg [OH] = 14 + lg (b×c0)
а) b - по строгой формуле 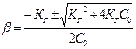
б) b - по приближенной формуле (если КГ<10-4):
b ≈  =
= 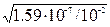 = 4×10-3 << 1 Þ расчет по приближенной формуле правомерен.
= 4×10-3 << 1 Þ расчет по приближенной формуле правомерен.
[OH] = b×c0 = 4×10-3×10-2 = 4×10-5 рН = 14 + lg [OH] =14 - 4,4 = 9,6
КГ = КВ/КД кислоты Þ  Þ сОН- =b×со Þ рН=14+ lg(
Þ сОН- =b×со Þ рН=14+ lg(  )
)
Аналогично:
Дата добавления: 2014-12-03; просмотров: 666;
