Решение. Соль FeCl3 полностью диссоциирует на ионы: FeCl3 Þ Fe3+ + 3 Cl
Соль FeCl3 полностью диссоциирует на ионы: FeCl3 Þ Fe3+ + 3 Cl . Обозначим через С0 искомую концентрацию соли. В соответствии со стехиометрией реакции в результате диссоциации образуется С0 ионов трехвалентного железа , которые подвергаются гидролизу :
Fe3+ + H2O Û FeOH2+ + H+ (1-я ступень ).
Обозначим через С равновесную концентрацию гидролизованных ионов FeOH2+ Тогда СFeOH+ = СH+ = С , а равновесная концентрация негидролизованных ионов Fe3+ будет равна (С0 – С) .
Запишем выражение для константы гидролиза:
KГ = CFeOH 2+. CH+ / CFe 3+ = C . C / (C0 - C) = KВ/KД FeOH 2+ .
С другой стороны, С = СH+ = 10-3 (моль/л) , так как по условию рН раствора равен 3. КД FeOH 2+ = 1,35.10-12. Подставляя эти значения в выражение для константы гидролиза, получаем :
КГ = 10-3 . 10-3 /( С0 -10-3 ) = 10-14 /1,35 . 10-12 = 7,4 .10-3, откуда С0= 1,14 . 10-3 (моль/л).
Ответ: С0 = 1,14 . 10-3 (моль/л ).
МАЛОРАСТВОРИМЫЕ ЭЛЕКТРОЛИТЫ
Растворимость CР, моль/л - концентрация насыщенного раствора электролита при данной температуре
Растворение прекращается , когда образуется насыщенный раствор.
В насыщенных растворах электролитов АnBm равновесие между твердой фазой и ионами в р-ре: АnBm(тв) Û n Am+(нас.p-р) + m Bn-(нас.p-р) - гетерогенный процесс
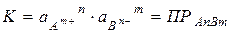 Произведение активностей ионов, содержащихся в насыщенном растворе электролита, в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимостей ПРАnBm
Произведение активностей ионов, содержащихся в насыщенном растворе электролита, в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимостей ПРАnBm
ПР25С - табличная величина
ПР зависит: от природы электролита, от температуры; ПР не зависит от активностей ионов.
Имеет практическое значение для малорастворимых соединений.
Пример: Ag2SO4(тв) Û 2Ag+(р-р) + SO42-(р-р)
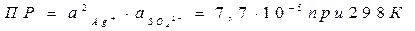
Условие выпадения осадка малорастворимого вещества из раствора
Если в данных условиях
ПА =  > ПРтабл – осадок выпадает
> ПРтабл – осадок выпадает
ПА = 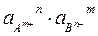 < ПРтабл – осадок не выпадает.
< ПРтабл – осадок не выпадает.
Дата добавления: 2014-12-03; просмотров: 1275;
