Осмотическое давление.
Осмос - самопроизвольный переход молекул растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией.
Осмотическое давление p- это минимальное давление, которое нужно приложить к раствору, чтобы остановить осмос.
↓ π
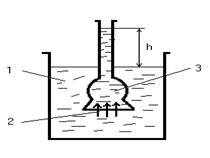 Мембрана пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба (h).
Мембрана пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба (h).
С1< С3
Обратный осмос – если внешнее давление, приложенное к более концентрированному раствору, выше осмотического, Р > p, то молекулы растворителя будут переходить из концентрированного раствора в разбавленный раствор (или чистый растворитель) т.к. скорость перехода молекул растворителя из концентрированного раствора будет больше. (Используется для очистки природных и сточных вод, для получения питьевой воды из морской воды).
Уравнение Вант Гоффа: p = СRT
где p - осмотическое давление, кПа;
С - молярная концентрация раствора, моль/л (1 Дж/л = 1 кПа)
R =8,3 Дж/(моль К) -универсальная газовая постоянная.
Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. В биологических процессах осмос обеспечивает поступление воды в клетки и регулирует обменные процессы.
Активность
Законы Рауля и Вант-Гоффа строго соблюдаются - в разбавленных растворах неэлектролитов. При повышении концентрации возрастают отклонения. Причина - взаимодействия между частицами растворенного вещества, а также растворенного вещества и растворителя. Выход –в формулыдля описания свойств реальных растворов вместо входящих в них концентраций компонентов подставляют активности.
Активность а связана с концентрацией С: а=gС, где g - коэффициент активности (безразмерная величина), формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора: 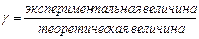
g - вычисляют по экспериментальнымданным как частное от деления экспериментально полученной величины (температуры кипения, замерзания и др.) на теоретически рассчитанную по законам идеальных растворов для данной концентрации; g-.
Дата добавления: 2014-12-03; просмотров: 1121;
