Осмотическое давление разбавленных растворов неэлектролитов
Осмотическое давление прямо пропорционально молярной концентрации раствора (СМ) и абсолютной температуре (Т). Эта зависимость дается уравнением Вант-Гоффа:
Росм=СМRT,
где R – универсальная газовая постоянная, значение которой определяется принятыми единицами измерения. Если давление измерять в Па, а объем в м3, то R=8,3144∙103Дж∙моль-1∙К-1; Т – абсолютная температура.
Поскольку СМ=n/V, то уравнение Вант-Гоффа аналогично уравнению Менделеева-Клапейрона, которое характеризует газовое состояние вещества:
РосмV=nRT или 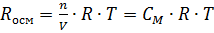 ,
,
где n – число молей растворенного вещества; V – объем раствора. Заменяя СМ в выражении Р=СМRT его выражением по формуле для молярной концентрации 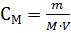 , где m – масса растворенного вещества; М – молярная масса растворенного вещества, получим формулу, удобную для вычисления молярной массы растворенного вещества [2].
, где m – масса растворенного вещества; М – молярная масса растворенного вещества, получим формулу, удобную для вычисления молярной массы растворенного вещества [2].
Пример 1. Вычисление осмотического давления растворов. Определить величину осмотического давления раствора, если в 500мл раствора содержится 1,8г глюкозы С4Н12О6 при 25оС.
Решение. Осмотическое давление раствора определяют согласно закону Вант-Гоффа: 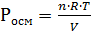 . В 0,5л раствора содержится 1,8 глюкозы, молярная масса которой равна 180г∙моль-1. Следовательно, в 0,5л раствора содержится n=1,8∙180=0,01моль глюкозы.
. В 0,5л раствора содержится 1,8 глюкозы, молярная масса которой равна 180г∙моль-1. Следовательно, в 0,5л раствора содержится n=1,8∙180=0,01моль глюкозы.
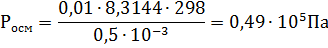
Пример 2. Вычисление молярной массы неэлектролита по относительному понижению давления пара растворителя над раствором.
Навеска вещества массой 12,42г растворена в воде объемом 500мл. Давление пара полученного раствора при 20оС равно 3732,7Па. Давление пара воды при той же температуре 3742Па. Как по этим данным найти молярную массу (М) растворенного вещества?
Решение. Для определения М надо вычислить n, пользуясь законом Рауля:
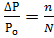 , откуда
, откуда 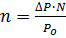 , так как ∆Р=3742-3732,7=9,3Па и
, так как ∆Р=3742-3732,7=9,3Па и 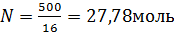 ,
,
то 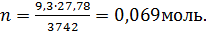
Поскольку 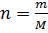 , то
, то 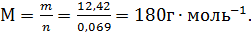
Дата добавления: 2014-12-24; просмотров: 1595;
