Физико-химические свойства фенольных соединений.
1. Мёртвая вода (Концепция общественной безопасности) СПб, 1998; 2000
2. Краткий курс... (Основы самоуправления общества) СПб, 1999
3. Руслан и Людмила (Развитие и становление государственности русского народа в глобальном историческом процессе, изложенное в системе образов Первого Поэта России А.С.Пушкина) СПб, 1999
4. Вопросы митрополиту Санкт-Петербургскому и Ладожскому Иоанну и иерархии русской православной церкви СПб, 1999
5. К Богодержавию... СПб, 1998
6. Медный всадник — это вам не медный змий... (О самой древней мафии в системе образов А.С.Пушкина)
СПб, 1998
7. Провидение — не “алгебра” (О работах А.Т.Фоменко и Г.В.Носовского по формированию модели реальной хронологии Истории на основе математической обработки повествований хроник) СПб, 1996, 2002
8. Чернильный визитёр (Рецензия на повесть С.Норка “Инквизитор”) СПб, 1997
9. Разгерметизация (Основы Концепции Истории в её понимании Внутренним Предиктором СССР, часть 1) СПб, 1997
10. От человекообразия к Человечности (От матриархата к Человечности...) СПб, 1999
11. Приди на помощь моему неверью... (О дианетике и саентологии по существу: взгляд со стороны) СПб, 1998
12. Троцкизм — это “вчера”, но никак не “завтра” (Печальное наследие Атлантиды) СПб, 1998
13. “Грыжу” экономики следует “вырезать” СПб, 1998
14. Да притечём и мы ко свету... СПб, 1998
15. Принципы кадровой политики государства, “антигосударства”, общественной инициативы СПб, 1999
16. Достаточно общая теория управления (Постановочные материалы учебного курса, прочитанного студентам факультета прикладной математики — процессов управления СПб государственного университета в 1997 — 2003 гг.) СПб, 2-я ред., 2003
17. О расовых доктринах: несостоятельны, но правдоподобныСПб, 2000
18. К пониманию макроэкономики государства и мира (Тезисы) СПб, 2002
19. Российское общество и гибель АПЛ «Курск»: история и перспективы (Аналитический сборник) СПб, 2000, 2002 (вторая редакция)
20. Дело было в Педженте (Второй смысловой ряд Фильма «Белое солнце пустыни») СПб, 2000
21. «Мастер и Маргарита»: гимн демонизму? Либо Евангелие беззаветной веры СПб, 2001
22. Время: начинаю про Сталина рассказ СПб, 2001
23. Об имитационно-провокационной деятельности СПб, 2001
24. Диалектика и атеизм: две сути несовместны СПб, 2001
25. Матрица “Матрице” — рознь СПб, 2001
26. В.В.Пчеловод «Последний гамбит» (Мистико-философский политический детектив) СПб 2001, 2002 (вторая редакция)
27. Старые сценарии на новый лад? (Сборник аналитических материалов разных лет по политической сценаристике) СПб, 2002
28. Форд и Сталин: о том, как жить по-человечески СПб, 2002
29. Троцкизм–“ленинизм” берёт “власть” («Разгермети-зация», Рукопись 1990 г. Глава 5 § 8. Анализ ошибок большевистской партии перед взятием власти в 1917 г.) СПб, 2002
30. От корпоративности под покровом идей к соборности в Богодержавии (О психологической подоплёке личности и её целенаправленном изменении) СПб, 2003
…и другие книги и текущая аналитика
Внутреннего Предиктора СССР
Интернет по Концепции Общественной Безопасности
«Мёртвая Вода»:
www.dotu.ru ; www.vodaspb.ru
Концептуальная партия «ЕДИНЕНИЕ»
Теоретической платформой партии является Концепция Общественной Безопасности с эпическим названием «Мёртвая Вода» (КОБ «МВ»). Она была разработана и скомпонована в сборник из материалов рабочей информационной базы ещё до начала развала СССР, в первой половине 1991 г., и была доложена высшему руководству страны, которое тогда не вникло в суть Концепции. Изначально книга была адресована не широкому читателю, а руководству Института США и Канады. Первоначальное название «Мёртвой Воды» — «Как вам реорганизовать Бнай-Брит». В период написания «Мёртвой Воды» цель была — не допустить развала СССР в предположении и надежде, что правящая партийно-государственная и научная “элита” одумается и найдёт в себе силы и мужество, чтобы изменить направленность реформ в стране ещё в то время, когда уже объявленные реформы не успели дать своих разрушительных результатов. Иными словами была цель: отсечь каналы управления со стороны угнетателей в лице библейской цивилизации и без катастроф войти в преображение псевдосоциализма — в нормальное общество справедливости.
Из древнего русского эпоса известно, что Мёртвая Вода — не мерзость, а средство: злые люди от неё чахнут, а добрые восстанавливают свои силы и даже сращивают ею расчленённые тела убитых богатырей. А потом возрождают их к жизни, окропив Живой Водой. СССР–Россия сегодня, как русский богатырь, умерщвлённый и разрубленный на части.
В 1992 году КОБ «Мёртвая Вода» была впервые издана тиражом 10 000 экз. В содержательном отношении «Мёртвая Вода» издания 1992 г. по-прежнему выше, чем любая из публикаций оппонентов, которые даже по её прочтении, не смеют обсуждать её в прессе открыто, а только намеками, или же цитируют мелкие её фрагменты, избегая показать целостность. Затянувшееся молчание, переходящее в тотальную информационную блокаду по отношению к ней как «справа», так и «слева», лишь косвенное доказательство её информационной мощи, её способности отразить ИНФОРМАЦИОННУЮ АГРЕССИЮ.
В 1995 году КОБ «МВ» прошла режим открытых парламентских слушаний в Госдуме, на которых была одобрена и рекомендована к внедрению.
В 1997 году сторонники КОБ создали Общероссийское Народное Движение «К Богодержавию» с отделениями в 72 регионах России. Сторонники КОБ есть во всех республиках СССР и за рубежом.
КОБ «МВ» за эти годы проникла во многие страны и вызвала там живой интерес. В первую очередь это Китай, Япония, все страны арабского мира, Израиль, Индия, страны Латинской Америки, конечно США (и в первую очередь Гарвардский университет), Европа (и в первую очередь Швейцария).
За прошедшие годы число сторонников КОБ непрерывно увеличивалось, и было принято решение создать концептуальную партию, стоящую на теоретической платформе КОБ, которая бы стала принимать самое активное участие в политической жизни общества и реализовывать теоретические положения КОБ на практике.
В июле 2000 года в городе Перми состоялся I съезд концептуальной партии — Всенародной Партии Мирной Воли «ЕДИНЕНИЕ». На съезде было 53 делегата из 30 субъектов России. Съезд принял Устав и Программу партии. 30 октября было выдано регистрационное свидетельство за номером 1812.
В декабре 2000 года в подмосковных Люберцах состоялся II съезд концептуальной партии, на котором были представлены уже 57 субъектов Российской Федерации. В работе съезда приняло участие более 300 человек. Были гости из республик СССР и зарубежных стран. Съезд принял решение реорганизовать партию в Общероссийскую ВПМВ «ЕДИНЕНИЕ», утвердил её Устав и принял Программу.
19 февраля 2001 года ОБЩЕРОССИЙСКАЯ политическая общественная организация — КОНЦЕПТУАЛЬНАЯ ПАРТИЯ «ЕДИНЕНИЕ» была зарегистрирована Министерством юстиции РФ за № 4003.
В соответствии с новым законом «О политических партиях» 12–14 апреля 2002 года в г. Звенигород Московской области прошёл III (внеочередной) съезд по преобразованию ВПМВ «Единение» в политическую партию «Концептуальная партия «Единение». Cъезд КПЕ подтвердил статус КПЕ как общероссийской политической общественной организации и привёл всю деятельность КПЕ в соответствие с требованиями нового закона «О политических партиях».
24 сентября 2002 года КПЕ была зарегистрирована Министерством Юстиции РФ за основным государственным регистрационным номером 1027746000831.
В состав КПЕ входит 53 региональные организации. Численность КПЕ на момент регистрации составляла 11 тысяч членов в 50 субъектах РФ. Председатель Центрального Совета КПЕ — Петров Константин Павлович.
Постоянно действующий орган КПЕ — центральный исполнительный комитет находится по адресу: 119296, г. Москва, Ленинский проспект, д. 68/10, кв. 90; тел/факс: 930–35–71; 747-29-68.
Штабы КПЕ:
г. Санкт–Петербург — тел. (812) 233-51-43; 373-88-39
г. Новосибирск — тел. (3832) 26-50-60
Internet: www.kpe.ru E-mail: mera@kpe.ru
Ефимов Виктор Алексеевич
ЭКОНОМИЧЕСКАЯ АЗБУКА
Подписано в печать 01.08.2003. Формат 60х88 1/16
Гарнитура «Times». Печать офсетная.
Объём Печ.л. 7,25. Усл. печ.л. 7,11. Уч.-изд.л. 6,24
Тираж 3000 экз.
Заказ № 19
Издательство «Общественная инициатива»
Телефоны для связи:
Санкт-Петербург: (812) 597-75-21; 225-15-53; 184-77-37; 248-84-83;
344-08-48; 588-62-74; 183-23-33; 592-21-90
E-mail: obshak@pochtamt.ru
Internet: www.dotu.ru ; www.vodaspb.ru
[1] Санкт-Петербургская газета «Компьютер-ИНФО».
Соон
|
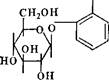
§ 2. Физпко-химнчеекпе свойства
Фенольные гликозиды в индивидуальном состоянии представляют собой белые кристаллические вещества, растворимые в воде, этиловом спирте, ацетоне, нерастворимые в этиловом эфире и хлороформе. Все фенольные гликозиды оптически активны в связи с при-
дствием в их молекуле углеводного компонента (как правило,
ИОКОЗЫ).
Фенольные гликозиды, как и все О-гликозиды, характеризуются юсобностью к гидролизу при нагревании с минеральными кисло- 1ми или при термостатировании с ферментами.
При гидролизе расщепление происходит до углеводного компо- :нта и соответствующего агликона. Подобный гидролиз происхо- IT и в живом организме под действием ферментов; при этом пер- шными продуктами метаболизма фенольных гликозидов являются ликон и сахар.
§ 3. Методы выделения и идентификация
Фенольные гликозиды извлекают из растительного материала иловым и метиловым спиртами (96, 70 и 40°). В дальнейшем истку спиртовых извлечений ведут общепринятым для гликози- в методом.
Выделение индивидуальных соединений проводят, как правило, годом адсорбционной хроматографии на полиамиде, силикагеле, члюлозе. В качестве элюирующих смесей используются вода юдный спирт, если адсорбентом служит полиамид или целлюлоза, 5о различные смеси органических растворителей для всех переменных адсорбентов.
Фенольные гликозиды в лекарственном растительном сырье -ут быть идентифицированы хроматографией в тонком слое )бента или на бумаге.
Для хроматографирования в тонком слое сорбента используют темы растворителей: 1) н-бутанол — уксусная кислота — вода 1 1 5); 2) н-бутанол — уксусная кислота — вода — ксилол 2:3:4); 3) хлороформ — метиловый спирт (8 : 2). При хроматографировании на бумаге используют 5, 10, 15%-ную усную кислоту.
Для индивидуальных веществ определяют температуру плавле- , удельное вращение, снимают УФ и ИК спектры. Рассмотрим и ИК спектры на примере арбутина. В связи с наличием в моле- е фенольных гликозидов ароматических С—С-связей фенольные козиды имеют максимум поглощения в УФ спектре при 2*70— нм. Максимум поглощения арбутина находится при 287 нм ожет быть использован как для качественной характеристики, и количественного определения арбутина в растительном мате- ле.
3 ИК спектре арбутина имеются характерные полосы при )—3400 см"1, обусловленные наличием спиртовых и фенольных юксильных групп; полоса 1515, 1460, 1440 см"1 типична для этических С=С-связей. Имеется ряд полос в области 800— 1 см"1 (область «отпечатка пальцев»). Совпадение спектров иссле- юго гликозида со спектром достоверного образца указывает дентичность соединений. Для идентификации фенольных гли-
козидов широко используются химические превращения (гидролиз, ацетилирование, метилирование и т. д.) и сравнение констант продуктов превращения с литературными данными для предполагаемого гликозида.
§ 4. Качественное определение
Фенольные гликозиды, имеющие свободную гидроксильную группу, дают все реакции, характерные для фенолов, например, с железоаммониевыми квасцами, реакцию диазотирования и др.
В случае если фенольный гидроксил гликозилирован, как у салицина, реакции проводят после предварительного гидролиза гликозида кислотами либо ферментами. Эти же качественные реакции используют для обнаружения феноль- ных гликозидов на хроматограммах.
В случае хроматографирования в тонком слое силикагеля хроматограммы можно обработать кроме перечисленных реактивов еще и 4%-ной H2S04 в абсолютном этиловом спирте.
При этом фенольные гликозиды в зависимости от строения обнаруживаются в виде желтых, красных, оранжевых или голубых пятен.
При обработке хроматограмм раствором нитрата серебра и щелочью фенольные гликозиды обнаруживаются в виде коричневых пятен с различным оттенком. При обработке хроматограмм реактивом Паули фенольные гликозиды в зависимости от строения проявляются в виде желтых, оранжевых или красных пятен.
Методики обнаружения арбутина в листьях толокнянки и брусники. 1. 0,5 г измельченного сырья кипятят с 10 мл воды 2—3 мин и после охлаждения фильтруют. К 1 мл фильтрата прибавляют кристаллик сульфата закисного железа; жидкость окрашивается сначала в сиреневый, затем темно-фиолетовый цвет, и, наконец, образуется темно-фиолетовый осадок (арбутин).
2. К 1 мл фильтрата (в фарфоровой чашке) прибавляют 4 мл раствора аммиака и 1 мл 10%-ного раствора натрия фосфорно-молиб- деновокислого в 10%-ной НС1; появляется синее окрашивание (арбутин).
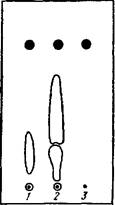 Рис. 8. Схема бумажной хроматограммы (БХ) фенологликози- дов толокнянки и брусники:
Рис. 8. Схема бумажной хроматограммы (БХ) фенологликози- дов толокнянки и брусники:
|
| 1 — извлечение из листьев толокнянки: 2—извлечение из листьев брусники; 3 — раствор арбутина |
3. 0,5 г мелкоизмельченного растительного сырья заливают 5 мл этилового спирта и экстрагируют при периодическом встряхивании и слабом нагревании на водяной бане в течение 1 ч. Полученное извлечение с помощью капилляра наносят на бумагу (3— 4 прикосновения капилляра) и хроматографируют восходящим
способом в 5%-ной уксусной кислоте до прохождения фронта растворителя 15—17 см (хроматограмма проходит в течение 1 ч при использовании бумаги FN-3). Хроматограмму вынимают, высушивают, обрабатывают раствором 10%-ной спиртовой щелочи и затем реактивом Паули. Арбутин имеет самое высокое значение Rf — 0,75, отделяется от сопутствующих гликозидов и проявляется в виде ярко-красного пятна (рис. 8). Аналогичные результаты можно получить на пластинке «Силуфол» при хрома-' тографировании в системе хлороформ — этиловый спирт (7 : 3) с последующей обработкой раствором щелочи и реактивом Паули.
Хроматограммы до и после обработки реактивами целесообразно просматривать в УФ свете с целью идентификации сырья по отдельным компонентам.
§ 5. Количественное определение
Нормативно-техническая документация (НТД) предусматривает количественное определение арбутина в листьях толокнянки и брусники. Метод определения основан на иодометрическом титровании гидрохинона, полученного после извлечения и гидролиза арбутина. Разработан спектрофотометрический метод определения салидро- зида в экстракте из корневищ с корнями радиолы розовой, который можно использовать для количественного определения салидро- зида в растительном материале. Исходя из строения фенольных гликозидов и их УФ спектров, возможно количественное хромато- спектрофотометрическое определение всех представителей этой группы.
Методика количественного определения арбутина в листьях толокнянки (Folium Uvae ursi) и листьях брусники (Folium Vitis idaeae). Около 0,5 г (точная навеска) сырья, измельченного и просеянного через сито с диаметром отверстий 1 мм, помещают в колбу вместимостью 100 мл, заливают 50 мл воды и кипятят 30 мин. Горячее извлечение фильтруют в мерную колбу вместимостью 100 мл, избегая попадания растительного материала на фильтр. Растительный материал в колбе заливают 25 мл воды и кипятят 20 мин. Горячее извлечение вместе с растительным материалом переносят на фильтр, фильтруют и остаток на фильтре промывают дважды по 10 мл горячей водой. К фильтрату в мерной колбе добавляют 3 мл раствора ацетата свинца, перемешивают и по охлаждении доводят объем до метки. Колбу нагревают на кипящей водяной бане до полного створаживания осадка. Горячую жидкость фильтруют в колбу, охлаждают, добавляют 1 мл концентрированной H2S04, колбу взвешивают, соединяют с обратным холодильником и кипятят при слабом кипении 1,5 ч. После охлаждения потерю в массе восстанавливают добавлением воды и жидкость фильтруют, к фильтрату добавляют 0,1 г цинковой пыли и встряхивают 5 мин. Жидкость нейтрализуют по лакмусовой бумажке гидрокарбонатом натрия, добавляют еще 2 г гидрокарбоната натрия и после его растворения фильтруют в сухую колбу. К 50 мл фильтрата прибавляют 200 мл воды и немедленно титруют из полумикробюретки 0,1 н. раствором иода до синего окрашивания, не исчезающего в течение 1 мин (индикатор — крахмал).
1 мл 0,1 н. раствора иода соответствует 0,01361 арбутина. Процентное содержание арбутина в растительном материале х в пересчете на абсолютно сухое сырье вычисляют по формуле
_ У0,01361 - 2-100 -100 * от (100—w) '
где V — объем 0,1 н. раствора иода, израсходованного на титрование, мл; т — масса навески сырья, г; w — потеря в массе сырья при высушивании, %.
Содержание арбутина в сырье регламентируется НТД.
Реактивы и оборудование: этиловый спирт (этанол); уксусная кислота 5%-ная; NaOH, 10%-ный раствор в метиловом спирте; реактив Паули; свинца ацетат (раствор); H2S04 (конц.); сульфат закисного железа; цинковая пыль; натрия гидрокарбонат; иод 0,1 н. раствор; крахмал.
Бумага хроматографическая; пластинки стеклянные; камера хроматографическая для БХ; колбы конические вместимостью 100 и 500 мл; полумикробюретки; воронки стеклянные для фильтрования диаметром 5 см; бумага фильтровальная.
ФЛОРОГЛЮЦИДЫ
Флороглюциды — одна из групп природных соединений, довольно широко распространенных у представителей рода щитовник. Они представляют большой интерес для практической медицины, имеют еще не совсем изученный химический состав. В настоящее время насчитывается не более 50 природных веществ с установленной структурой.
Эти соединения обладают различным биологическим действием: антигельминтным, желчегонным, противовирусным, противонар- котическим и др. В качестве официнального в СССР и в большинстве фармакопей других стран включено корневище мужского папорт- ника семейства многоножковых. Некоторые фармакопеи зарубежных стран допускают использование корневищ папоротников австрийского, игольчатого, раскидистого.
§ 6. Классификация
Флороглюциды являются соединениями, производными флоро- глюцина или пирона. Они встречаются в виде мономеров или веществ, связанных группой (—СН2) в димеры, тримеры или тетра- меры. Мономерные соединения в свою очередь подразделяются на: а) бутирилфлороглюцин и его производные; б) метилбутирилфло-
н3сч ,сня
J
НО-/\-ОН HO-/V-OH НО-/\-ОН|_с с н._ ! с г н !
\/ 3 7 I 87 \/
ОН 0 (i)H 0 о
бутирилфлороглюцин метилбутирилфлоро- филициновая
глюцнн кислота
К димерным веществам относятся: а) производные бутирилфло- роглюцина и метилбутирилфлороглюцина, например флораспидинол; б) производные ацилфилициновых кислот: альбаспидин и его гомологи; в) производные ацилфилициновых кислот, бутирил- флороглюцина, метилбутирилфлороглюцина, флаваспидовая кислота и ее гомологи, и др., например, флаваспидовая кислота; г) производные 2,3-дигидро-2-окси-6-пропил-у-пирона (флораспирон и флоропирон):
СН,
НО-/\-ОСН, н,СО-У\-ОН НА-С i I J—с—с3н7
,1 у \ /У [ о Ан \сн/ Ан о
флораспидинол
НзСч^^СНз Н/^СН,
НО——ОН ОН—ОН Н7С3-С-^Х 1]_С-С3Н7
О А \сн/ i о
альбаспидин
Н3СХ/СН3
НО—/\-0Н НО-/\-ОН н7с3-с-^х А/-С-С3Н7
А \сн/ Тн А
флаваспидовая кислота
HA-/°Vo H£Q-/VOH
9 1 V )-С-С3Н7
\сн/ Ан 6
флораспирон
| роглюцин и его "метоксилированные производные; в) филициновая кислота и ее производные: СН, |
Из тримерных соединений известно не более 5 веществ с установленной структурой. Так, из папоротника мужского выделена
К тетрамерным соединениям относят два известных в настоящее время природных вещества, одно из них метилен-бмс-норфлаваспи- довая кислота.
| филиксовая кислота: |
|
| НА-' |
| —С—QH7 |
| Н-Ггн. СОС3Н7 н г гц Н< Н |
§ Л. Физико-химические свойства флороглюцидов
Флороглюциды обладают кислотным характером, обусловленным гидроксильными группами, связанными с ароматическим кольцом. Бензольное кольцо, вступая в реакцию с целым рядом реагентов, дает соединения с характерной окраской, что используется для обнаружения флороглюцидов в растениях. Флороглюцино- вые производные при отсутствии в их структуре пространственных затруднений способны к образованию межмолекулярных и внутримолекулярных связей. Они имеют характерную область поглощения в УФ спектрах (215—240 и 240—380 нм); кристаллизуются в виде веществ желтого, реже белого цвета; нерастворимы в воде, растворимы в органических растворителях (избирательно), хорошо — в щелочах и жирных маслах.
§ 8. Методы выделения и идентификация
Выделение производных флороглюцина из растительного сырья проводят экстракцией различными органическими растворителями: этиловым эфиром, хлороформом, ацетоном, этиловым и метиловым
%%
ЯП
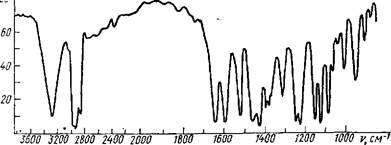 Рис. 9. И К спектр аспидинола
Рис. 9. И К спектр аспидинола
|
спиртами. Получаемый после отгонки растворителя густой экстракт обрабатывают водным раствором гидроксида бария, оксида магния и т. д., в результате чего флороглюциды переходят в феноляты.
Водные растворы затем подкисляют концентрированными соляной, серной или уксусной кислотами, при этом в осадок выпадает сумма флороглюцидов, называемая сырым филицином.
Хроматографический метод считается наиболее подходящим для разделения производных флороглюцина и чаще всего используется
при изучении этих веществ. Для этих целей применяют бумажную хроматографию, хроматографию в тонком слое сорбента и хроматографический метод разделения на колонках. Адсорбентом служат си- ликагель, диоксид кремния, полиамид, оксид алюминия. В качестве подвижной фазы используются смеси: петролейный эфир — хлороформ (1 : 1); бензол — хлороформ (1 : 1); циклогексан — хло- . роформ (1 : 1); гексан — петролей-
'2W 260--------- Ш----- зЬ—AjiM ный ЭФИР (1 ! 1) с 5 % этилового
спирта и др. На хроматограмме для Рио. 10. УФ спектр аспидинола обнаружения производных флороглюцина используют их свойства флуоресцировать в УФ свете, а также давать окрашенные соединения с диазореактивами.
Строение веществ устанавливается на основании элементного анализа, температуры плавления, получения производных, в результате щелочного гидролиза (у ди- и полимеров), УФ, ИК, ПМР и масс-спектроскопии. На рис. 9 и 10 приведены данные спектра УФ и ИК для мономера аспидинола, выделенного из корневищ мужского папоротника.
§ 9. Качественное определение
Получение извлечения: 1 г Измельченного сырья помещают в колбу с притертой пробкой, заливают 4-кратным количеством хлороформа (этиловый, метиловый спирт) и оставляют на сутки, периодически взбалтывая. Затем фильтруют через бумажный фильтр (извлечение «А»).
Получение сырого филицина. 10 г измельченных корневищ сырья заливают восьмикратным количеством этилового спирта, взбалтывают в течение 30 мин и оставляют на 3 ч для экстракции. Извлечение фильтруют и упаривают в вакууме при температуре 55—60 °С до густой консистенции. Остаток обрабатывают несколько раз насыщенным раствором гидроксида бария и фильтруют. Фильтрат подкисляют концентрированной НС1 до рН 2,0. Выпавший осадок сырого филицина отфильтровывают, промывают дистиллированной водой и высушивают в эксикаторе.
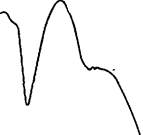
| ige ¥ 3,5 3.0 |
Методики качественных реакций. 1. К 1 мл извлечения добавляют 3—5 капель смеси равных объемов 1 %-ного раствора FeCl3 и K4Fe(CN)e. Образуется темно-зеленое окрашивание.
2. К 1 мл извлечения добавляют 2—3 капли реактива Паули по Кутачеку: вишнево-красная окраска переходит в оранжевую.
3. К 1 мл извлечения прибавляют раствор ванилина в концентрированной НС1: появляется красное окрашивание.
4. К 1 мл извлечения добавляют раствор FeCl3, K4Fe(CN)e (1 : 1) и 10 капель концентрированной НК03. Образуется темно-бурое окрашивание.
5. Хроматографическое определение. На пластинку «Силуфол», пропитанную лимонно-фосфатным буфером (рН 6,0), с последующим активированием пластинки при температуре 70—80 °С (1 ч) наносят 1 °о-ный сырой филицин из мужского папоротника (5—6%-ный раствор из игольчатого папоротника) в хлороформе капилляром в одно касание на стартовую линию хроматографической пластинки, высота жидкости в капилляре 1,5—2 см, диаметр полученного пятна 2—3 мм. Высушенную пластинку помещают в хроматографиче- скую камеру со свежеприготовленной, насыщенной системой н-гексан — хлороформ (1 1) с 5 % этилового спирта. Время хроматографирования 1 ч. Хроматограмму высушивают на воздухе и просматривают в УФ свете, отмечая зону флуоресценции. Проявляют флороглюциновые производные реактивом Паули по Кутачеку, отмечая цвет пятен (рис. 11).
В мужском папоротнике обнаруживаются не менее 6 пятен, из них идентифицированы флаваспидовая кислота, ас- пидинол, альбаспидин; в игольчатом папоротнике не менее 8 пятен, для 4 из них установлено строение (флаваспидовая кислота, аспидинол, дезас- пидин и аспидин).
Хроматографическое разделение можно проводить в тонком слое силикагеля марки КСК, смешивая 4 г силикагеля с 10 мл лимонно- фосфатного буфера с рН 6,0 и последующим активированием- пластинки в течение 1 ч при t = 105—110 °С в той же системе.
| а " «4Ш» 0 даяа S ф Ь # а I I I ® О / |
| Рис. 11. Схема хромато граммы (ТСХ) флороглю- цинов игольчатого и мужского папоротников: 1 — раствор сырого филицина из корневищ игольчатого папоротника; 2 — раствор сырого филицина из корневищ мужского папоротника; а — аспидин, б — дезаспи- дин, в — аспидинол; ггх — флаваспидовая кислота (тау- томерные формы); д — аль баспидин |
§ 10. Количественное определение
Методы количественного определения производных флороглю- цина ограничивались в фармакопеях различных стран только определением сырого филицина. В литературе имеются сведения о разработке хроматоспектрофотометрических методов определения фло-
3 п/р Гринкевнч и др.
роглюцидов в кристаллическом порошке и сырье, в частности для флаваспидовой, ацетилфлаваспидовой кислот, аспидина, аспиди- нола. Метод основан на способности поглощать фенольные соединения в УФ области при определенных длинах волн, характерных для этого класса соединений.
Методика определения суммы сырого филицина из корневищ мужского папоротника — Rhizoma Filicis maris (Dryopteris filix mas L.) (ГФ X, ст. 584). 50 г псрошка корневищ экстрагируют около 2 ч в аппарате Сокслета этиловым эфиром до тех пор, пока эфир не будет стекать бесцветным и 10 мл эфирного извлечения не перестанут оставлять при испарении видимого остатка. Извлечение фильтруют, эфир отгоняют на водяной бане до 30 мл, после чего остаток взбалтывают в делительной воронке с 30 мл насыщенного раствора гидро- ксида бария в течение 5 мин. После разделения слоев водный слой фильтруют. 24 мл фильтрата (40 г сырья) смешивают с 4 мл концентрированной НС1 и последовательно взбалтывают с 30, 20, 15 мл этилового эфира. Объединенные эфирные извлечения обезвоживают 4 г безводного Na2S04 и фильтруют через складчатый фильтр во взвешенную колбу. Сульфат натрия и фильтр промывают этиловым эфиром дважды по 10 мл. Эфир отгоняют на водяной бане, а остаток сушат в течение 1 ч при 100 °С. Процентное содержание филицина х рассчитывают по формуле
_ а\00 -100 т (100 —ш) '
где а — количество сырого филицина, полученного после отгонки этилового эфира, г; т — масса навески сырья, вычисленная по отмеренному объему фильтрата, г; w — потеря в массе сырья при высушивании.
Содержание сырого филицина в корневищах должно быть не менее 1,8 %.
Реактивы и оборудование: лимонная кислота; натрия фосфат двузамещенный; Ва(ОН)2; стрептоцид белый; NaN02; FeCl3; K4Fe(CN)e; ванилин; хлороформ; к-гексан; этиловый спирт (этанол); н-бутанол (бутанол-1); НС1 (конц.); этиловый эфир; Na2S04; реактив Паули по Кутачеку [белый стрептоцид (3 г); н-бутанол (14 мл); НС1 (конц., 6 мл); вода дистиллированная (200мл), хранятв темной склянке, в реактив перед употреблением добавляют натрий нитрит кристаллический]; лимонно-фосфатный буфер с рН 6,0 [смесь двух растворов (раствор А — 0,2 М Na2HP04 и раствор В —0,1 М лимонной кислоты)]. Для получения 20 мл буфера смешивают 12,63 мл раствора А и 7,37 мл раствора В (рН проверяют по универсальному индикатору).
Аппарат Сокслета; силикагель марки KCK; шкаф сушильный лабораторный; колба круглодонная с нормальным шлифом вместимостью 500 мл; бани водяные лабораторные; воронки стеклянные для фильтрования диаметром 5— 10 см; холодильник стеклянный лабораторный; фильтры бумажные; пробирки стеклянные; камера хроматографическая для ТСХ; капилляры стеклянные; пластинки «Силуфол»; пластинки стеклянные для ТСХ размером 20 X 20 см; пульверизатор; колбы конические вместимостью 100 мл; весы ручные; весы лабораторные аналитические; ступки фарфоровые с пестиком или кофемолка электрическая бытовая.
Вопросы для подготовки
Физико-химические свойства фенольных соединений.
Дата добавления: 2014-12-02; просмотров: 2228;
