Но о он
I
/\/\/Л
\/\/\/-\сн2он
Н/хГл XXIV
§ 2. Физико-химические свойства
Антраценпроизводные — кристаллические вещества желтого, оранжевого или красного цвета. Свободные агликоны хорошо растворяются в этиловом эфире, хлороформе, бензоле и других органических растворителях; в воде не растворяются, но хорошо растворимы в водных растворах щелочей за счет образования фенолятов.
В форме гликозидов антраценпроизводные хорошо растворяются в воде, еще лучше — в щелочи, хуже — этаноле и метаноле; нерастворимы в органических растворителях — бензоле, этиловом эфире, хлороформе и др.
При нагревании до 210 °С антраценпроизводные сублимируются.
Большинство антраценпроизводных флуоресцирует при воз- ждении УФ и сине-фиолетовым светом. При этом характер флуо- :ценции зависит как от степени окисленности основного ядра, к и от числа и расположения заместителей: антрахиноны харак- ризуются, как правило, оранжевой, розовой, красной и огненно- асной флуоресценцией; антроны и антранолы — желтой, голу- й, фиолетовой.
§ 3. Методы выделения и идентификация

|
Для выделения антрагликозидов растительный материал экстра- руют водой, спиртами (этиловым, метиловым) или водно-спирто- ши смесями. Агликоны лучше растворимы в органических раство- ггелях, но растворимость их избирательная. Для получения агли- )нов гликозиды в растительном материале*подвергают гидролизу, 1гревая с кислотой, или энзиматическому расщеплению, после :го извлекают свободные агликоны этиловым эфиром, бензолом ни хлороформом. Антрахиноны, имеющие в качестве заместителя эрбоксильную группу, растворяются в водных растворах карбо- атов и гидрокарбонатов щелочных металлов и их гидроксидов образованием солей. Антрахиноны с гидроксилом в (J-положении г взаимодействуют с гидрокарбонатами, а с водными растворами арбонатов и гидроксидов щелочных металлов дают феноляты. 1ещества, содержащие а-гидроксил, образуют феноляты только растворах щелочей. Различие свойств оксигрупп в а- и Р-положе- иях объясняется тем, что а-гидроксилы образуют внутримолеку- ярную водородную связь с соседней карбонильной группой и потому обладают меньшей реакционной способностью:
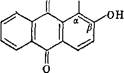
|
На различии свойств антраценпроизводных в зависимости от характера и расположения заместителей основаны все классические летоды разделения этих соединений. Основным методом разделения штраценпроизводных является хроматографический. В качестве сорбента при этом наиболее успешно применяется полиамид; хорошие результаты дает также силикагель. Растворителями при раз- целении антрагликозидов служат главным образом водно-спиртовые смеси, а при разделении агликонов — бензол, толуол, хлороформ.
Идентификация проводится с помощью химических и физических методов, которые дополняют друг друга. Из физических методов наиболее полную информацию дают спектральные, которые позволяют установить класс соединений, а также наличие и характер заместителей.
УФ спектроскопия широко используется в структурных исследованиях антраценпроизводных. В УФ области эти соединения имеют несколько максимумов поглощения выше 200 нм. Каждый тип замещения характеризуется определенным набором спектральных характеристик, что используется при установлении структуры новых соединений этой группы (рис. 12).

| 200 250 300 350 т Ш 500Я,нм Рис. 12. УФ спектр реина |
ИК спектроскопия нашла наиболее широкое применение при изучении структуры антраценпроизводных, так как ИК спектры этих соединений специфичны и могут быть использованы для идентификации. Наличие ароматических колец в антрахиноне обусловливает появление интенсивной полосы в области 1578—1596 см-1 (рис. 13). Производные антрахи- нона, не имеющие а-гидроксилов, дают одну сильную полосу в области 1678—1653 см-1, обусловленную
карбонильными группами хиноидного кольца. а-Гидроксилы характеризуются широкой полосой с центром 2900 см"1, что объясняется образованием внутримолекулярной водородной связи между а-гиД- роксилами и хиноидным карбонилом. (З-Гидроксильные группы могут быть определены по появлению полосы в области 3400—3150 см-1,

|
| 3800 3200 2600 2000 1800 №0 1W Рис. 13. ИК спектр реина |
| 1200 1000 v см'1 |
что типично для оксигрупп, способных образовывать межмолекулярные водородные связи. У производных антрона свободная карбонильная группа хиноидного кольца поглощает в области 1654 см-1. Таким образом, при изучении структуры антраценпроизводных с помощью инфракрасной спектроскопии используют главным образом частоту поглощения отдельных групп и заместителей соединения.
ЯМР спектроскопия также находит применение для изучения :труктуры антраценпроизводных. Характер спектра ядерного магнитного резонанса в основном определяется числом и положением ароматических протонов, а также положением и строением водород- содержащих заместителей.
§ 4. Качественное определение
Методики качественных реакций. 1. Реакция со щелочью. 0,2 г измельченного растительного материала кипятят в течение 2 мин с 5 мл 10%-ного NaOH. После остывания смесь разбавляют 5 мл воды и фильтруют. 3 мл фильтрата помещают в пробирку, добавляют 3 мл 10%-ной НС1 и 10 мл бензола. Осторожно перемешивают и после расслоения жидкости сливают бензольный слой, фильтруя его через небольшой комочек ваты. Фильтрат встряхивают с 3 мл 10%-ного раствора аммиака.
При наличии антраценпроизводных аммиачный слой принимает вишнево-красное (1,8-диоксиантрахиноны), пурпурное (1,4-диокси- антрахиноны) или фиолетовое (1,2-диоксиантрахиноны) окрашивание.
Сущность реакции в следующем: при кипячении растительного материала со щелочью происходит гидролиз-антрагликозидов с образованием свободных агликонов. Одновременно антрон- и антра- нолпроизводные окисляются до антрахинонов. Образовавшиеся оксиантрахиноны за счет фенольных гидроксилов дают феноляты, растворимые в воде. При подкислении водно-щелочного извлечения диссоциация фенольных гидроксилов подавляется и соединения становятся липофильными, в результате чего при встряхивании с бензолом они из водного слоя переходят в бензол; бензольный слой при этом принимает желтую окраску оксиантрахинонов. При встряхивании бензольного слоя с раствором аммиака вновь происходит образование фенолятов антрахинонов и они переходят в ам- "миачный слой. Феноляты оксиантрахинонов имеют яркий вишнево- красный, пурпурный или фиолетовый цвет в зависимости от положения оксигрупп.
2. Сублимация антраценпроизводных. На дно сухой пробирки помещают 0,2 г измельченного растительного материала и осторожно нагревают, держа пробирку почти горизонтально. Температура сублимации 210 °С, время сублимации 10 мин.
Сублимат конденсируется на холодных участках пробирки в виде желтых капель или желтых игольчатых кристаллов. После остывания пробирки к сублимату прибавляют 1 каплю 5%-ного NaOH в этиловом спирте; появляется яркое красное или фиолетовое окрашивание в зависимости от состава антраценпроизводных (образование фенолятов). Сущность реакции: содержащиеся в растительном материале антрагликозиды при высокой температуре расщепляются с образованием свободных агликонов; одновременно производные антрона и антранола окисляются до антрахинонов, которые возгоняются.
Таблица 1
| Хроматограмма после проявления КОН | ||||
| № п/п | № | Название вещества | ||
| рисунков | пятна | флуоресценция в | ||
| цвет пятна в | ||||
| видимом свете | Уф свете | |||
| Рис. 14 | Бесцветный | Светло-зеленая | ||
| > | Слабо-фиолетовая | |||
| » | Ярко-фиолетовая | |||
| Слабо-желтый | Слабо-оранжевая | |||
| Красный | Оранжево-красная | |||
| Светло-желтый | Светло-голубая | |||
| Слабо-желтый | Ячко-фиолетовая | |||
| Темно-желтый | Те шо-коричневая | |||
| Серо-коричневый | Темно-серая | |||
| Красный | Фиолетово-красная | Франгулаэмодин | ||
| Рис. 15 | о | Бесцветный | Слабо-оранжевая | |
| £ 3 | Слабо-желтый | Слабо-темно-фиоле | ||
| товая | ||||
| » | Светло-зеленая | |||
| Слабо-красный | Фиолетовая | |||
| Красный | Оранжево-красная | Антрагликозиды | ||
| Слабо-красный | Фиолетово-красная | » | ||
| Слабо-желтый | Слабо-оранжевая | |||
| Темно-желтый | Темно-коричневая | |||
| Красный | Фиолетово-красная | Франгулаэмодин | ||
| Рис. 16 | Розоватый | Оранжево-красная | ||
| Слегка сероватый | Светло-зеленая | |||
| ЗГ | Красный | Ярко-оранжевая | ГлюкофранТ'улин | |
| > | Красно-оранжевая | |||
| Бесцветный | Светло-зеленая | |||
| Розовый | Розовая | |||
| Оранжевый | Оранжево-красная | Франгулин | ||
| Красный | Фиолетово-красная | Франгулаэмодин | ||
| Рис. 17 | О | Ярко-желтый | Темно-желтая | |
| Z | > Бесцветный | > Светло-зеленая | ||
| Слабо-желтый | Красная | |||
| » | Розовая | |||
| Слабо-оранжевый | Оранжево-красная | Франгулин | ||
| Слабо-желтый | Желтая | |||
| Красный | Фиолетово-красная | Франгулаэмодин | ||
| Слабо-зеленый | Розовая | Хлорофилл | ||
| Рис. 18 | Оранжевый | Оранжевая | Луцидинпримве- | |
| розид | ||||
| Красный | Огненно-красная | Руберитриновая ки | ||
| слота |
| № п/п рисунков | № * пятна | Хроматограмма после проявления КОН | Название вещества | |
| цвет пятна в видимом свете | флуоресценция в Уф свете | |||
| Слабо-желтый > Бесцветный > > Пурпурно-фиолето- вый | Слабо-оранжевая » Слабо-розовая » Слабо-фиолетовая Темно-коричневая | Ализарин | ||
| Рис. 19 | 1 2 8 9 | Бесцветный Слабо-желтый Ярко-желтый Слабо-оранжевый Очень слабо-оранжевый Бесцветный Слабо-фиолетово- красный Зеленовато-серый Зеленый | Фиолетовая Желто-зеленая > Красная Розовая Голубая Красно-фиолетовая Желтая Красная | Рейн Хлорофилл |
Методики хроматографического определения. При анализе лекарственного растительного сырья, содержащего антраценпроизводные, используется хроматография на бумаге и в тонком слое сорбента.
При исследовании состава антрагликозидов готовят водные извлечения; при анализе состава агликонов сырье экстрагируют бензолом, этиловым или метиловым спиртом, которые при нагревании более или менее удовлетворительно экстрагируют как свободные антраценпроизводные, так и их гликозидные формы.
0,3 г измельченного растительного материала нагревают с 3 мл этилового спирта в течение 5 мин, доводя до слабого кипения. После остывания фильтруют. 0,1 мл фильтрата наносят на линию старта и хроматографируют в системе этилацетат — метиловый спирт — вода (100 : 17 : 13) на пластинках «Силуфол». Время хроматогра- фирования 30—40 мин. Хроматограмму высушивают на воздухе, обрабатывают 5%-ным NaOH в этиловом спирте и рассматривают при дневном свете и УФ свете до и после обработки. Одновременно хроматографируют стандарт «свидетель», нанося его раствор рядом с исследуемым извлечением. По величине Rf, характеру окраски и флуоресценции пятен идентифицируют антраценпроизводные исследуемого сырья (рис. 14—19). В табл. 1 даны пояснения к рисункам.
| I ! 0 |о | .Оз | ||
| ЮООО 0 blOo N lo 1 | >*> | О О' C4j | • ^ |
| w ГО S а. к о с D |
| ins U. W Ч/-Ч |
| pj 3J je Л X 5 МЭ SB 5 я Я О я v £ з S а. е cr ST о ft, Я S * я |
| о. 3 Ч'О О) я ^ Л ш to от н S <s ч § Я « о во 15 S я s5 s&il ^ * й ч о I Т g* И - я х £ S3 SS. с! S 5 I go У ПЗ >=£ lot, 31 Си О _ 4 о а Ее |
| I 0 10 | ||||
| |о о ( Оо «ч | (О | ООО vj- СЧ1 | о • ^ |
| 2 я х S3 S Я Я а. о О, l. а |
О
| О « О В о я Н Я Я я ™ д Я О О щ ° н S о.* J g ¥ ос g я Я а. я Jos х Щ _, " as « й К я 2 _ Я Ч * S S о. аЗ О „кйй « я «о gS^s 3 « Зх !»?« о 3"СЗ «м м » & IS.1 |
о'о'оооооо оо
|CD0 оо оо О оо
| я« I в = Зю 2 Ф я-ч сх г Я в «Я о t; я .. ^ а о я о «*<* Я Л C{g Ч О щ щ ° S | S о a 2 ч ё а 2<Ч 5> в th% | а | я "С |
| о л о S- Я X «Од S Q.4 о с о О. X х Щ и ЕГ э , S Ё з | «И |
| g 5 Й » S 2 Й 5 С я и> 5 leg g&g О* Я 2 2„& И я я , 2 b „8 1 3 Isg-a я = S 2 3 3 8-8 • s я. 7 £ я м 3 1 й-я Q. о __ О я Q. и я "С и 8 |
J^O, <*> N <0 ^ ^ ^^
| N? п/п >исунков | № пятна | Хроматограмма после проявления КОН | Название вещества | |
| цвет пятна в видимом свете | флуоресценция в Уф свете | |||
| Слабо-желтый » Бесцветный » » Пурпурно-фиолетовый | Слабо-оранжевая > Слабо-розовая » Слабо-фиолетовая Темно-коричневая | Ализарин | ||
| Рис. 19 | 8 9 | Бесцветный Слабо-желтый Ярко-желтый Слабо-оранжевый Очень слабо-оранжевый Бесцветный Слабо-фиолетово- красный Зеленовато-серый Зеленый | Фиолетовая Желто-зеленая » Красная Розовая Голубая Красно-фиолетовая Желтая Красная | Рейн Хлорофилл |
Методики хроматографического определения. При анализе лекарственного растительного сырья, содержащего антраценпроиз- водные, используется хроматография на бумаге и в тонком слое сорбента.
При исследовании состава антрагликозидов готовят водные извлечения; при анализе состава агликонов сырье экстрагируют бензолом, этиловым или метиловым спиртом, которые при нагревании более или менее удовлетворительно экстрагируют как свободные антраценпроизводные, так и их гликозидные формы.
0,3 г измельченного растительного материала нагревают с 3 мл этилового спирта в течение 5 мин, доводя до слабого кипения. После остывания фильтруют. 0,1 мл фильтрата наносят на линию старта и хроматографируют в системе этилацетат — метиловый спирт — вода (100 : 17 : 13) на пластинках «Силуфол». Время хроматогра- фирования 30—40 мин. Хроматограмму высушивают на воздухе, обрабатывают 5%-ным NaOH в этиловом спирте и рассматривают при дневном свете и УФ свете до и после обработки. Одновременно хроматографируют стандарт «свидетель», нанося его раствор рядом с исследуемым извлечением. По величине Rf, характеру окраски и флуоресценции пятен идентифицируют антраценпроизводные исследуемого сырья (рис. 14—19). В табл. 1 даны пояснения к рисункам.
| ' » ! 0 | |||
| jo | •ча | ||
| ЮООО 0 | Г\ v ' | о о | • -ч: |
| loifto N lo ^ ^ |
| 6 га я в л я t- So в 4 я 2 о я «S3 S ас; «г £ о о с о go = о. е 4 s; m ® И га о s " 5,5, S fT н = v O.S я Sg^l 8s|S. rj М й л о 'б'-Э f-'як Я чод S3 г т ^ i v У га 5 I о й J? о- О >=! о а "и с s |
| н ш 2 S I «9 |
| 1 | | |||||
| 1 f | • СО | ||||
| io | * •«* | ||||
| !о | ООО | о | |||
| (О | «л. | Sj-N, C4j |
| ото ' я S- я X в от я я о д 5 5.4 о, S а. е р 5 -в" о с 3 g ■ о ll- sssl S-S о „ о S I я ояа'ч * а « я SQ3 5, м n g a Ci 2 >,я s £ 3 х « S3 « ,1 s я | a . я "rag I й| о |
| <и |
| О ОТ £ В я «I й я е в £ 5 2 о >< »«>■ S3 CL ^ В" Щ ^ S с и «а» о. я « ч™ *§н 3 я яТ га 5 к . • вз J я S О. И О .. ш я |ggS -35 s-i J Si У « S о. 5 ® о. о _ о я Q- и m Nil. 6 т и в о я h S S 5 feя га о о 3 2 ь S а.* В g V 2 е ё я « о. а 5 о я к S ~ " а « 33 О 2 S.5 Й Я н » 2 ¥ ft 2 в Sо 8 5 5,3 w ч 3 я QBfl -J — ЯР. 2 з X * -9 S3 , S В . я = 3 ' S1 jr л. о СХиа ^яЧ |
| • 1<э | ||
| 00 <00 ООО О ОС) | • X | |
| 55 О) оо К h Сч| |
| «It, | ||
| GD0 ооооо оо | ||
| ^О, Ixtoki^f^ СМ *- | ||
ри исследовании антрагликозидов хроматографирование ведут стеме этилацетат — муравьиная кислота — вода (10 : 2 : 3); из свободных антраценпроизводных ведут в толуоле (хромато- ия на бумаге).
| 8 О | сэ | |
| 7 О | ||
| 6 О | ||
| ш J О | ||
| го /о | О | О |
| • А | • б | • • в Г |
| Рис. 18. Схема хромато- граммы антраценпроизводных марены красильной: |
А — этанольное извлечение корней и корневищ марены красильной; Б — рубери- триновая кислота; В — лу- цидинпримверозид; Г — али- аарнн
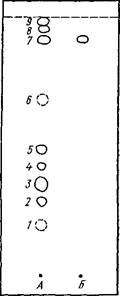 Рис. 19. Схема хромато- граммы антраценпроизводных кассии остролистной:
Рис. 19. Схема хромато- граммы антраценпроизводных кассии остролистной:
|
А — этанольное извлечение из листьев кассии остролистной; Б — реин
§ 5. Количественное определение
Большинство методов количественного определения антра- производных предусматривает определение суммы свободных иантрахинонов после предварительного гидролиза антраглико- ов.
В настоящее время наиболее широко применяется колориметри- кий метод, предложенный Аутергофом, в различных модифика- х. Метод принят ГФ X для определения антраценпроизводных екарственном растительном сырье. Метод ГФ X с некоторыми мнениями (в целях безопасности работы этиловый эфир заме- [ хлороформом) приводится ниже.
Методика количественного определения суммы антраценпроиз- ных (свободных и связанных в виде гликозидов). 0,05 г (точная 1еска) порошка исследуемого сырья помещают в круглодонную колбу с нормальным шлифом вместимостью 100 мл, соединяют с обратным холодильником и подвергают гидролизу путем кипячения в течение 15 мин с 7,5 мл ледяной уксусной кислоты (при исследовании коры крушины ольховидной, корня ревеня) или с 7,5 мл ледяной уксусной кислоты и 1 мл концентрированной НС1 (при исследовании листьев сенны, корневища и корня марены). Во время нагревания колбу слегка покачивают, чтобы не допустить приго- рания растительного материала. После остывания в колбу, не снимая холодильника, прибавляют 30 мл хлороформа и кипятят на водяной бане в течение 15 мин для экстрагирования свободных антраценпроизводных. После остывания (колбу вместе с холодильником снять с водяной бани) хлороформное извлечение фильтруют через вату в делительную воронку вместимостью 300 мл. Колбу дважды ополаскивают хлороформом (по 10 мл) и, пропуская через эту же вату, выливают в делительную воронку; вату дважды промывают хлороформом (по 5 мл).
К хлороформному извлечению в делительной воронке прибавляют 40 мл воды и, слегка покачивая воронку, добиваются перемешивания слоев жидкости, чтобы отмыть избыток кислоты. После полного расслоения нижний, хлороформный, слой сливаю?" в коническую колбу вместимостью 250 мл, а водный слой отбрасывают. Из колбы хлороформное извлечение вновь переносят в делительную воронку и приливают туда щелочно-аммиачного раствора (5%-ного NaOH, содержащего 2%-ный аммиак), предварительно ополоснув им колбу. Покачивая делительную воронку в виде «8», добиваются тщательного перемешивания слоев жидкости, чтобы извлечь антраценпроизводные щелочно-аммиачным раствором из хлороформа. Через 5 мин делительную воронку оставляют в покое, и после полного расслоения жидкости сливают нижний, хлороформный, слой в коническую колбу; красный или фиолетовый, прозрачный водно-щелочной слой сливают в мерную колбу вместимостью 250 мл. Хлороформный слой вновь переносят в делительную воронку, приливают туда 20 мл щелочно-аммиачного раствора, предварительно ополоснув им колбу, и вновь извлекают антраценпроизводные, как описано выше, до тех пор, пока водно-щелочной слой перестанет окрашиваться.
Собранные водно-щелочные извлечения доводят в мерной колбе до метки щелочно-аммиачным раствором и перемешивают. 25 мл полученного окрашенного раствора помещают в круглодонную колбу с нормальным шлифом, соединяют с обратным холодильником и нагревают на кипящей водяной бане в течение 15 мин. После остывания измеряют оптическую плотность раствора на фотоэлектро- колориметре с зеленым светофильтром (А, = 525 нм) в кювете толщиной слоя 10 мм (нулевую точку устанавливают по дистиллированной воде). При получении слишком интенсивной окраски раствор перед колориметрированием разбавляют щелочно-аммиачным раствором.
Концентрацию антраценпроизводных в колориметрическом растворе, выраженную в истизине, определяют по калибровочному афику, построенному по хлориду кобальта (СоС12-6Н20). Для >го готовят от 0,2 до 3,0%-ные растворы хлорида кобальта (10— растворов равномерно возрастающей концентрации) и измеряют оптическую плотность на этом же фотоэлектроколориметре (ка- бровочный график студенты получают готовым). По оси ординат кладывают значение оптической плотности, а оси абсцисс — нцентрацию антраценпроизводных в миллиграммах на 100 мл, ходя из того, что 1 %-ный хлорид кобальта по оптической плот- сти соответствует 0,36 мг истизина в 100 мл щелочно-аммиачного створа. Приготовление эталонных растворов и определение их тической плотности производят не менее 3 раз. Процентное содержание антраценпроизводных в пересчете на солютно сухое сырье вычисляют по формуле
аУК
Х тЮ (100 — ш) '
е а — концентрация антраценпроизводных в мг на 100 мл, най- нная по калибровочному графику; V — первоначальный объем елочного извлечения, мл; т — масса навески сырья, г; w — поря в массе сырья при высушивании, %; К — коэффициент разбав- ния раствора перед колориметрированием. Методика количественного определения антрагликозидов. Около 5 г (точная навеска) измельченного сырья помещают в колбу fecTiiMOCTbK) 150 мл, приливают 100 мл воды, перемешивают 10 мин нагревают с обратным холодильником в кипящей водяной бане течение 15 мин при периодическом перемешивании (покачивании), осле охлаждения под струей воды смесь перемешивают, дают 'стоиться 10 мин и фильтруют через бумажный складчатый фильтр, i мл полученного извлечения помещают в колбу вместимостью Ю мл, прибавляют 2,5 мл 50%-ной H2S04 и нагревают в кипящей >дяной бане при периодическом перемешивании в течение 30 мин. осле охлаждения раствор переносят в делительную воронку вме- гимостью 300 мл, а колбу ополаскивают 10 мл воды и 60 мл хлоро- эрма. Промывные воды и хлороформ присоединяют к основному звлёчению в делительной воронке и- взбалтывают в течение 5 мин. осле отстаивания хлороформный слой отделяют, а извлечение )балтывают с новой порцией (30 мл) хлороформа. К объединенному чороформному извлечению прибавляют 50 мл щелочно-аммиач- эго раствора и осторожно взбалтывают в течение 5 мин. После гстаивания прозрачный водный слой сливают в мерную колбу яестимостью 100 мл, доводят щелочно-аммиачным раствором до етки и перемешивают. 25 мл полученного раствора помещают коническую колбу с обратным холодильником и нагревают в кипя- 1ей водяной бане в течение 15 мин. После охлаждения жидкость оличественно переносят в мерную колбу вместимостью 50 мл и оводят объем щелочно-аммиачным раствором до метки.
Оптическую плотность раствора измеряют с помощью спектро- отометра при X = 525 нм в кювете с толщиной слоя 10 мм, исполь- уя в качестве раствора сравнения щелочно-аммиачный раствор.
Концентрацию производных антрацена в растворе, выраженную в хризофановой кислоте, определяют по калибровочному графику, построенному по растворам хлорида кобальта. Процентное содержание антраценпроизводных (в пересчете на антрагликозиды) х вычисляют по формуле
_ аЮО-100-50-100-100-1,59 _ а8-1,59 Х~ 1000- 1000/П25 ■ 25 (100 — w) ~m(100 — w) '
где а — концентрация антраценпроизводных испытуемого раствора, найденная по калибровочному графику, мг/л; т — масса навески сырья, г; до — потеря в массе сырья при высушивании, %; 1,59 — отношение средней массы антрагликозидов к средней массе агликонов.
Для определения отдельных соединений антраценпроизводных пользуются хроматоспектрофотометрическими методами. Из растительного материала антраценпроизводные экстрагируют в виде гликозидов или свободных агликонов и разделяют с помощью хроматографии на бумаге или в тонком слое силикагеля. Для разделения антраценпроизводных, извлекаемых метиловым спиртом (антрагликозиды и свободные агликоны), предложен метод тонкослойной хроматографии на силикагеле марки КСК в системе растворителей бензол — метиловый спирт (4 : 1). Пятна антраценпроизводных на хроматограмме отмечают в УФ свете и собирают каждое пятно на стеклянный фильтр № 4. Фильтр промывают 0,5 н. NaOH, количественно переносят в мерные колбы емкостью 50 мл и доводят объем до метки 0,5 н. NaOH. Через 20 мин определяют оптическую плотность растворов по максимуму поглощения в УФ области.
Реактивы и оборудование: хлороформ; толуол; метиловый спирт (метанол); этиловый спирт (этанол); этилацетат; бензол; муравьиная кислота; уксусная кислота (лед.); НС1 (конц. и 10%-ная); H2S04 (50%-ная); NaOH (0,5 н. и 10%-ный); NaOH (5%-ный в этиловом спирте); аммиак (10%-ный); ще- лочно-аммиачный раствор (NaOH 5%-ный, содержащий 2%-ный аммиак); кобальта хлорид; магния ацетат (1%-ный раствор в этиловом спирте).
Пластинки «Силуфол».
Хроматографическая бумага «С»; фотоэлектроколориметр; спектрофотометр; УФ лампа; колбы конические вместимостью 50, 100, 250 мл; колбы круглодонные с нормальным шлифом вместимостью 50, 100 мл; колбы мерные вместимостью 25, 50, 100, 250 мл; воронки делительные вместимостью 100, 250, 300 мл, холодильники (обратные) стеклянные лабораторные с нормальным шлифом; камеры хрома- тографические для ТСХ; камеры хроматографические для БХ; пробирки стеклянные; штативы для делительных воронок; фильтры стеклянные № 4, воронки стеклянные для фильтрования диаметром 5 см; штативы лабораторные, плитки электрические; бани водяные лабораторные; весы лабораторные аналитические.
Вопросы для подготовки
1. Какие природные вещества называют антраценпроизводными?
2. Что лежит в основе классификации антраценпроизводных, на какие группы их разделяют?
3. В каком виде антраценпроизводные находятся в растении?
4. Какими реакциями можно открыть антраценпроизводные в растительном сырье?
5. Что происходит с антраценпроизводными и их гликозидами при нагревании растительного сырья?
6. Чем обусловлена растворимость свободных антраценпроизводных в вод» [X растворах щелочи?
7. Какое свойство антраценпроизводных можно использовать для установ- ния их локализации в тканях растения?
8. Какими физико-химическими свойствами характеризуются свободные траценпроизводные и их гликозиды?
9. В чем сущность метода количественного определения антраценпроиз- дных в лекарственном растительном сырье?
10. Какие реакции можно использовать для проявления антраценпроизвод-IXна хроматограммах?
Литература
Георгиевский В. П., Казаринов Н. А., Каррыев М. О. Физико-химические тоды анализа биологически активных веществ растительного происхожде- [я. — Ашхабад: Ылым, 1976.
Дата добавления: 2014-12-02; просмотров: 1758;
