Степени окисления мышьяка, селена, брома
| Элемент | Степень окисления | Соединения | |
| Высшая | низшая | ||
| As | +5 | -3 | Н3АsO4; Н3Аs |
| Se | +6 | -2 | SeO3; Na2Se |
| Br | +7 | -1 | HBrO4; KBr |
Пример 2. У какого из элементов четвертого периода – марганца или брома – сильнее выражены металлические свойства?
Решение. Электронные формулы данных элементов
25Mn 1s22s22p63s23p63d54s2
35Br 1s22s22p63s23p63d104s24p5
Марганец – d-элемент VIIB-группы, а бром – р-элемент VIIA-группы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции.
Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Пример 3. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления образующих их атомов? Какие гидроксиды называются амфотерными (амфолитами)?
Решение. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э-O и O-Н может протекать по двум направлениям:
Э – О – Н

 ЭОН Э+ + ОН –
ЭОН Э+ + ОН –

 ЭОН ЭО– + Н +
ЭОН ЭО– + Н +
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислородному типу (II) протекает, если Ео-н « Еэ-о (высокая степень окисления), а по основному типу, если Ео-н >> Еэ-о (низкая степень окисления). Если прочность связей O-Н и Э-O близки или равны, то диссоциация гидроксида может одновременно протекать и по (I), и по (II) направлениям. В этом случае речь идет об амфотерных электролитах (амфолитах):
Эn+ + nОН– ↔ Э(ОН)n = НnЭОn ↔ nН+ + ЭОn n–
как основание как кислота
где: Э – элемент;
n – его положительная степень окисления.
В кислой среде амфолит проявляет основной характер, а в щелочной среде – кислотный характер:
Ca(OH)3 + 3HCl = CaCl3 + 3H2O
Ca(OH)3 + 3NaOH = Na3CaO3 + 3H2O
Пример 4. Изотоп 101-го элемента — менделевия (256) был получен бомбардировкой 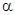 -частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение. Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращение атомных ядер как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элдмента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением:

Часто применяют сокращенную форму записи. Для приведенной реакции она имеет вид: 253Es ( 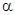 , n)256Md. В скобках пишут бомбардирующую частицу, а через запятую — частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы
, n)256Md. В скобках пишут бомбардирующую частицу, а через запятую — частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы  обозначают соответственно
обозначают соответственно 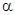 , p, d, п.
, p, d, п.
Пример 5. Исходя из сокращенных уравнений ядерных реакций (табл. 2), напишите их полные уравнения.
Решение. Ответ на вопрос см. в табл. 12.
Таблица 12
Дата добавления: 2014-12-26; просмотров: 1447;
