Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны:
АО s, p, d, f
МО σ, π, δ, φ
3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе МО ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода).
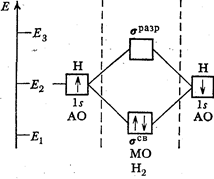 Рис. 12. Энергетическая схема образования молекулы водорода Н2
Рис. 12. Энергетическая схема образования молекулы водорода Н2
|
Рассмотрение химических связей в методе МО заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи.
Пользуясь положениями 1—3, объясним образование молекулы H2 с точки зрения метода МО. При достаточном сближении атомов водорода происходит перекрывание их электронных орбиталей. Согласно п. 3 из двух одинаковых ls-орбиталей образуются две молекулярные орбитали: одна из них от сложения атомных орбиталей, другая от их вычитания (рис.12). Энергия первой E1 < E2, а энергия второй E2 < E3.
Молекулярная орбиталь, энергия которой меньше энергии атомной орбитали изолированного атома, называется связывающей (обозначается символом 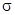 св), а находящиеся на ней электроны—связывающими электронами.
св), а находящиеся на ней электроны—связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом 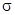 разр), а находящиеся на ней электроны — разрыхляющими электронами.
разр), а находящиеся на ней электроны — разрыхляющими электронами.
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую МО, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу МО образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe2, так как в ней два электрона находились бы на связывающей орбитали и два — на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
В системе обозначений метода МО реакцию образования молекулы водорода из атомов записывают так:
2H[1s1] = H2[(σ CB1s)2],
т. е. используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. При этом символ каждой МО заключается в круглые скобки и над скобками справа проставляется число электронов на этой орбитали.
Число валентных связей определяется по формуле:
NСВ - N разр
 B =
B =
где: В – число связей;
NСВ, N разр – соответственно число связывающих и разрыхляющих электронов в молекуле.
В молекуле водорода В = (2—0) : 2=1, водород одновалентен. Молекула Н2 диамагнитна (электроны спарены).
Теперь легко объясняется одноэлектронная связь в молекулярном ионе Н2+ (рис.13). Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь 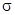 св1s. Уравнение процесса:
св1s. Уравнение процесса:
H[1s1] + H+ = H2+[(σсв1s)1], ∆H = - 259,4 кДж


Рис. 13. Энергетическая схема образования Рис. 14. Энергетическая схема
молекулярного иона водорода H2 образования дигелий-иона Hе2
Число связей в ионе H2+ равно ½ (связь одним электроном). Ион H2+ — парамагнитен (имеет один неспаренный электрон).
Возможно существование молекулярного дигелий иона Не2+ (рис.14). Уравнение его образования
He[1s2] + He+[1s1] = He2+ [(σCB 1s)2 (σ разр1s)1], ∆H = - 292,8 кДж
Этот ион экспериментально обнаружен. Число связей в нем (2—1) : 2 = 1/2.  Ион— парамагнитен (имеет неспаренный электрон).
Ион— парамагнитен (имеет неспаренный электрон).
4.5.2. Основные двухатомные гомонуклеарные молекулы элементов 2-го периода.Рассмотренный принцип построения МО из двух одинаковых АО сохраняется при построении гомонуклеарных молекул элементов 2-го периода системы Д.И. Менделеева. Они образуются в результате взаимодействия 2s- и 2рx-, 2рy- и 2рz-орбиталей.
Участием внутренних электронов 1s-орбиталей можно пренебречь (на последующих энергетических схемах они не учтены). 2s-орбиталь одного атома взаимодействует только с 2s-орбиталью другого атома (должна быть близость значений энергий взаимодействующих орбиталей), образуя МО σ2sсв и σ2sразр. При перекрывании (взаимодействии) 2р-орбиталей обоих атомов образуются МО: σхсв, σхразр, πусв, πуразр, πzсв, πzразр
 (рис.15). Т.е. из шести исходных 2р-орбиталей образуется шесть МО – три связывающих и три разрыхляющих. МО, образующиеся из s- и рx-атомных орбиталей, обозначаются буквой
(рис.15). Т.е. из шести исходных 2р-орбиталей образуется шесть МО – три связывающих и три разрыхляющих. МО, образующиеся из s- и рx-атомных орбиталей, обозначаются буквой 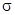 , а из ру- и рz- – буквой
, а из ру- и рz- – буквой 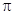 . С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода МО.
. С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода МО.
Пример 1. Молекула лития Li2. Схема ее образования представлена на рис.16. В ней два связывающих электрона, молекула диамагнитна (электроны спарены). Написание уравнения и формулы можно упростить, обозначив внутренний уровень через K:
2Li[K2s] = Li2[KK(σCB2s)2]
Число связей равно 1.
Пример 2. Молекула бериллия Be2. Восемь электронов молекулы размещены на МО следующим образом:
Ве2[KK(σ CB2s)2 (σ разр2s)2]
Как видно, число связей в молекуле равно нулю: два разрыхляющих электрона уничтожают действие двух связывающих. Такая молекула не может существовать, и она до сих пор не обнаружена. Необходимо отметить, что невозможны двухатомные молекулы у всех элементов IIА-группы, палладия и инертных элементов, так как их атомы имеют замкнутую электронную структуру.
Пример 3. Молекула азота N2 (рис. 17). Распределение 14 электронов по МО записывается так:
N2[(σCB1s)2(σ разр1s)2(σ CB2s)2(σ разр2s)2(πCB2py)2(πCB2pz)2(σ CB2px)2]
или сокращенно:
N2[КК (σsCB)2 (σsразр)2(πyCB)2(πzCB)2(σxCB)2]
+1 -1 +1 +1 +1=3

Рис. 17. Энергетическая схема образования молекулы N2
Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связующие орбитали, знак минус – разрыхляющие. Число связей в молекуле 3. нет неспаренных электронов – молекула диамагнитна.
Пример 4. Молекула O2 (рис. 18). Электроны размещаются по МО в последовательности:
O2[КК (σsCB)2 (σsразр)2(πyCB)2(πzCB)2(σxCB)2 (πyразр)1(πzразр)1]
+1 -1 +1 +1 +1 - 1/2 - 1/2 =2
 В молекуле две валентные связи. Последние два электрона разместились на различных π-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.
В молекуле две валентные связи. Последние два электрона разместились на различных π-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода. Энергетическая схема образования МО гетеронуклеарных двухатомных молекул, состоящих из атомов элементов 2-го периода, представлена на рис. 19. Она сходна со схемой образования МО гомонуклеарных молекул.
Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, поскольку различны заряды ядер атомов. В качестве примера рассмотрим электронную валентную конфигурацию молекул СО и NO.
 Пример 5.Молекула СО. Внешняя электронная оболочка атома углерода имеет конфигурацию 2s22p2, а кислорода 2s22p4. Стало быть, в заполнении МО молекулы СО принимают участие 4+6=10 электронов. Из них два размещаются на орбитали σ2sсв , два – на орбитали σ2sразр, четыре – на орбиталях πyCB и πzCB, а девятый и десятый – на σхсв. Таким образом, электронную валентную конфигурацию молекулы СО можно выразить формулой:
Пример 5.Молекула СО. Внешняя электронная оболочка атома углерода имеет конфигурацию 2s22p2, а кислорода 2s22p4. Стало быть, в заполнении МО молекулы СО принимают участие 4+6=10 электронов. Из них два размещаются на орбитали σ2sсв , два – на орбитали σ2sразр, четыре – на орбиталях πyCB и πzCB, а девятый и десятый – на σхсв. Таким образом, электронную валентную конфигурацию молекулы СО можно выразить формулой:
СО[КК(σsCB)2 (σs разр)2(πyCB)2(πzCB)2 (σхCB)2]
+1 -1 +1 +1 +1=3
Как и предусматривалось теорией ВС, в молекуле СО три валентные связи (сравните с N2). Молекула диамагнитна – все электроны спарены.
Пример 6. Молекула NO. На МО молекулы оксида азота (II) должны разместиться 11 электронов: пять азота – 2s22p3 и шесть кислорода – 2s22p4. Десять изних размещаются так же, как и электроны молекулы оксида углерода (II) (пример 5), а одиннадцатый разместится на одной из разрыхляющих орбиталей – πy разр или πZ разр (эти орбитали энергетически эквивалентны между собой). Тогда
NО[КК (σsCB)2 (σs разр)2(πyCB)2(πzCB)2 (σхCB)2(πyразр)1]
+1 -1 +1 +1 +1 - 1/2=21/2
Значит, молекула NO имеет две с половиной валентные связи, энергия связи большая —677,8кДж/моль. Она парамагнитна, так как содержит один неспаренный электрон.
Приведенные примеры служат иллюстрацией возможностей метода МО в объяснении строения и свойств молекул.
Пример 7. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора 3s23р3 (учитывая правило Хунда, 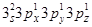 )по квантовым ячейкам имеет вид:
)по квантовым ячейкам имеет вид:
s p d









15P ↑↓ ↑ ↑ ↑
3 s 3 рx 3 py 3 pz
Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:
s p d









15P ↑ ↑ ↑ ↑ ↑
3 s 3px 3py 3 pz 3dxy
Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Пример 8. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp2-, sp3-гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в табл. 13.
Таблица 13.
Дата добавления: 2014-12-26; просмотров: 3628;
