КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
В данном разделе рассматриваются получение и свойства комплексных соединений. Для выполнения предлагаемой работы необходимо иметь представление о комплексных соединениях, об их строении, прочности и окислительно-восстановительной способности.
Центральное место в комплексном соединении занимает комплексообразователь -обычно атом или положительно заряженный ион (чаще всего металл). Типичными комплексообразователями являются d-элементы периодической системы Д. И. Менделеева. Частицы (ионы или молекулы), располагающиеся вокруг комплексообразователей, называются лигандами. Обычно в роли лигандов выступают анионы или полярные молекулы. В любом случае они имеют, по крайней мере, одну неподеленную пару валентных электронов. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Ионы, нейтрализующие суммарный заряд ионов внутренней сферы и располагающие более отдаленно от комплексообразователя, образуют внешнюю сферу. При написании формул комплексных соединений комплексообразователь с лигандами, т.е. внутреннюю сферу, заключают в квадратные скобки. Этим подчеркивается, что в растворах комплексный ион практически не диссоциирует на составляющие его ионы или молекулы. Соединения с малоустойчивой внутренней сферой называют двойными солями.
В некоторых случаях образование связи между ионом металла и лигандами можно объяснить их электростатическим притяжением. В большинстве случаев связь между комплексообразователем (акцептор) и лигандом (донор) осуществляется по донорно-акцепторному механизму. Число, показывающее, сколько лигандов вокруг себя удерживает комплексообразователь, называется координационным числом. Лиганды, образующие с комплексообразователем одну связь, называются монодентантными, две связи - бидентантными и т. д.
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов.
Комплексные соединения при диссоциации образуют комплексные ионы, например: [Ag(NH3)2]Cl Û [Ag(NH3)2]+ + С1-. Такая диссоциация обычно протекает полностью. Комплексные ионы в свою очередь подвергаются вторичной диссоциации: [Ag(NH3)2]+ Û Ag+ + 2NH3. Эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс, получим выражение констант нестойкости комплексных ионов:
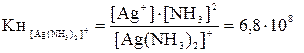
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. Константы нестойкости некоторых комплексных ионов приведены в таблице приложения.
Так как диссоциация комплексного иона является процессом обратимым,то, выводя из его сферы ионы, можно практически разрушить комплекс. В качестве примера можно рассмотреть взаимодействие НNО3 с [Ag(NH3)2]Cl.
[Ag(NH3)2]Cl + НNО3 = AgCl¯ + 2NН4NО3.
Разрушение комплекса может произойти и в результате образования какого-либо более прочного комплекса, т.е. обладающего меньшей константой нестойкости.
Пространственное расположение составных частей комплексного соединения часто может быть нарушено без изменения состава молекулы в целом. Так, например, составу CrCl3.6H2O соответствуют три вещества. В молекуле фиолетовой соли все шесть молекул воды находятся во внутренней сфере [Cr(H2O)6]Cl3.
При нагревании часть молекул воды удаляется из внутренней сферы, уступая место хлорид-ионам. При этом образуются следующие комплексные соли.
[Cr(H2O)5Cl]Cl2.H2O светло- зеленого цвета
[Cr(H2O)4Cl2]Cl.2H2O темно- зеленого цвета
Изомерия, подобная наблюдаемой уCrCl3.6H2O, называется гидратной изомерией, так как обусловлена различным пространственным расположением молекул воды в комплексном соединении. В комплексных соединениях, как показано выше, наблюдаются и другие виды изомерии.
Дата добавления: 2014-12-26; просмотров: 1946;
