Расчет растворимости солей и минералов
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. При заданных условиях концентрация насыщенного раствора не изменяется во времени. Её называют растворимостью и обозначают заглавной буквой английского термина «Solubility» S. Растворимость зависит от температуры и состава раствора. Обычно её рассчитывают на основе термодинамических констант. Рассмотрим равновесие между солью, состоящей из катионов металла Mz+ и анионов кислотного остатка Az-, и её насыщенным раствором. При этом учтем, что все соли - сильные электролиты, полностью диссоциирующие в растворе.
Мn+Аn-(т)=n+Мz+(р-р)+n-Аz-(р-р). (1)
Константу данного равновесия называют произведением растворимости соли и обозначают L. Запишем её выражение согласно закону действующих масс учитывая, что активность чистого растворенного вещества равна 1 (стандартное состояние).
L = a+n+×a-n- = [Mz+]n+×[Az-]n-×g±n, (2)
где n = n+ + n- , а среднеионный коэффициент активности g± = (g+n+×g-n-)1/n. Выражение (2) используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости берут в справочнике или вычисляют по величине энергии Гиббса растворения соли:
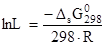 (3)
(3)
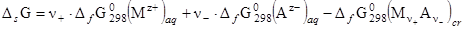 (4)
(4)
Дата добавления: 2014-12-26; просмотров: 1040;
