Лекция №12: Гидролиз солей.
Гидролизом солей является процесс химического взаимодействия солей с водой. Таким образом, гидролизом называют взаимодействие вещества с водой, при котором составные части вещества соединятся с составными частями воды. Например, следующие реакции являются реакциями гидролиза:
KCN+H2O=HCN+KOH
AlCl3+H2O=Al(OH)Cl2+HCl
Гидролизу подвергаются следующие соли, образованные:
а) слабой кислотой и слабым основанием;
б) слабой кислотой и сильным основанием;
в) сильной кислотой и слабым основанием.
Соли же, образованные сильной кислотой и сильным основанием, не гидролизуются, а процесс нейтрализации в этом случае сводится к следующему:
Н++ОН- = Н2О. Следует учитывать, что обратная реакция диссоциации воды на ионы протекает в мизерной степени.
Слабыми кислотами являются: HNO2, H2SO3, H2O2, CH3COOH, H2SiO3, HF, H2CO3, HCN, H2S, H3PO4, NH4OH. Сильными кислотами являются: HNO3, H2SO4, HCl, HBr, HJ, НClO4, НMnO4. Cильными основаниями являются все щелочи кроме NH4OH (например КОН, NaOH, Ba(OH)2, Ca(OH)2).
Рассмотрим подробнее основные три случая гидролиза солей:
1. Гидролиз соли, образованной слабой кислотой и сильным основанием (на примере ацетата натрия):
CH3COONa+H2O=CH3COOH+NaOH
CH3COO- +H2O=CH3COOH+OH-
В данном случае гидролизуется анион соли, а реакция сопровождается образованием ионов ОН-. Реакция среды – щелочная.
2. Гидролиз соли, образованной слабым основанием и сильной кислотой:
NH4NO3+H2O=NH4OH+HNO3
NH4++H2O=NH4OH+H+
Здесь гидролизуется катион соли и реакция сопровождается образованием ионов Н+. Реакция среды – кислая.
3. Гидролиз соли, образованной слабой кислотой и слабым основанием:
CH3COONH4+H2O=CH3COOH+NH4OH
CH3COO- + NH4+ +H2O=CH3COOH+NH4OH
Здесь гидролиз идёт и по катиону, и по аниону с образованием сразу двух слабых электролитов. Среда в растворах таких солей зависит от относительной силы образующихся в результате гидролиза кислоты и основания, но в целом близка к нейтральной.
4. Соль, образованная сильной кислотой и сильным основанием, не гидролизуется:
KNO3+H2O¹
KClO4+H2O¹
Гидролизу подвергается не вся соль, а лишь её часть, т.е. в растворе устанавливается равновесие между солью и образующими её кислотой и основанием. Поэтому часть вещества, подвергающаяся гидролизу, характеризуется степенью гидролиза. Степень гидролиза зависит от константы равновесия, температуры и концентрации соли, а также от её природы. Природа соли проявляется в величине константы гидролиза соли.
Константа гидролиза соли Кг характеризует способность данной соли подвергаться гидролизу. Чем больше Кг, тем в большей степени протекает гидролиз (при постоянстве Т и концентрации соли).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием, равна:
Кг= 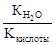 , где Ккислоты – константа диссоциации кислоты. Анализ уравнения показывает, что чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.
, где Ккислоты – константа диссоциации кислоты. Анализ уравнения показывает, что чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.
Константа гидролиза соли, образованной сильной кислотой и слабым основанием, равна:
Кг= 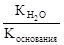 , где Коснования – константа диссоциации основания. Анализ уравнения показывает, что чем слабее основание, тем в большей степени подвергаются гидролизу им образованные соли.
, где Коснования – константа диссоциации основания. Анализ уравнения показывает, что чем слабее основание, тем в большей степени подвергаются гидролизу им образованные соли.
Константа гидролиза соли, образованной слабой кислотой и слабым основанием, равна:
Кг= 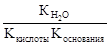 .
.
Зависимость степени гидролиза от концентрации соли проявляется в том, что с разбавлением раствора степень гидролиза растёт. Влияние температуры на степень гидролиза вытекает из рассмотренного ранее принципа Ле Шателье: степень гидролиза растёт с повышением температуры. Поэтому для ослабления гидролиза растворы необходимо хранить концентрированными и при низких температурах. Для солей, образованных сильной кислотой и слабым основанием, фактором подавления гидролиза является подкисление раствора, а в случае соли, образованной слабой кислотой и сильным основанием, таковым фактором является подщелачивание раствора.
Процесс гидролиза может протекать ступенчато, например:
 Na2CO3+H2O=NaHCO3+NaOH I ступень
Na2CO3+H2O=NaHCO3+NaOH I ступень
CO32- +H2O=HCO3- +OH-
NaHCO3- +H2O=H2CO3+OH- II ступень
HCO3- +H2O=H2CO3+OH-
Как видно из уравнения реакции гидролиза, в первой ступени образуется гидрокарбонат ион, диссоциация которого характеризуется второй константой диссоциации угольной кислоты, а во второй ступени происходит гидролиз кислой соли с образованием угольной кислоты, диссоциацию которой характеризует первая константа её диссоциации. Поэтому можно связать константу гидролиза по первой ступени К1 со второй константой диссоциации кислоты К2 кисл, а константу гидролиза по второй ступени К2 с первой константой диссоциации кислоты К1 кисл:
К1= 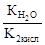 >К2=
>К2= 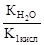 .
.
Гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Аналогично протекает гидролиз соли, образованной слабым основанием многовалентного металла.
Особенно глубоко протекает гидролиз соли, образованной слабой кислотой и слабым основанием, т.к. константа гидролиза для этого случая обратно пропорциональна произведению констант диссоциации кислоты и основания, т.е. её значение крайне велико.
Согласно протонной теории кислот и оснований гидролиз можно представить как частный случай кислотно-основного равновесия: протон переходит от молекулы воды к данному иону или от данного иона к молекуле воды. Примером может служить гидролиз иона аммония:
NH4++H2O= H3О++NH3.
Дата добавления: 2014-12-26; просмотров: 2120;
