Растворимость в многокомпонентной системе с одноименными ионами
Рассмотрим расчет растворимости соли Мn+Аn- в системе, содержащей хорошо растворимую соль M¢Аn¢с одноименным анионом. Пример такой системы: PbCl2 - NaCl- H2O. В этом случае используют формулу (2). Катионы Mz+переходят в раствор только из осадка, поэтому их концентрация определена растворимостью: [Mz+] = n+S. Однако концентрация анионов в растворе складывается из двух составляющих, обусловленных, во-первых, растворимостью труднорастворимой соли n-S, и, во-вторых, концентрацией соли М¢An¢, которую обозначим n¢С¢. После подстановки в формулу (2) получим:
L = (n+S)n+(n-S + n¢C¢)n-×g±n. (6)
Растворимость находят путем решения степенного уравнения (6). Если растворимость меньше концентрации соли с одноименным ионом в 100 и более раз, то есть n-S < 0,01n¢C¢, то возможны упрощения. Во-первых, пренебрегают в сумме меньшим слагаемым и получают:
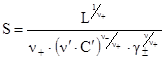 (7)
(7)
Во-вторых, при расчете коэффициента активности пренебрегают вкладом труднорастворимой соли в ионную силу. Аналогично вычисляют растворимость в присутствии одноименного катиона. Следует отметить, что растворимость в присутствии одноименных ионов всегда понижается, так как их концентрация в (7) стоит в знаменателе дроби.
Дата добавления: 2014-12-26; просмотров: 1002;
