В изолированной системе
А) Р = const, T = const;
B) P = const, V = const;
C) U = const, V = const;
D) U = const, T = const;
E) V = const, T = const.
$$$ 7
При каком процессе, производимом идеальным газом, справедлива формула для работы?
А = Р(V2 - V1)?
А) изотермическом;
В) изобарном;
С) изохорном;
D) адиабатическом;
Е) любом обратимом.
$$$ 8
Как выражается 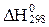 реакции через теплоты образования участвующих в ней веществ (
реакции через теплоты образования участвующих в ней веществ ( 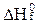 ): 4СО + 2SО2 = S2 + 4CO2
): 4СО + 2SО2 = S2 + 4CO2
А) 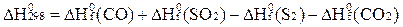 ;
;
В) 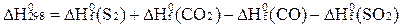 ;
;
С) 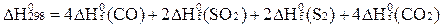 ;
;
D)  ;
;
Е)  .
.
$$$ 9
Какую размерность имеет молярная теплоемкость?
А) Дж/моль;
В) Дж/К;
С) Дж/моль К;
D) Дж моль/К;
Е) моль К/Дж.
$$$ 20
Стандартная теплота сгорания углерода (С ) равна 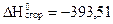 кДж/моль. В какой из приведенных реакции тепловой эффект при Т = 298К равен этой величине?
кДж/моль. В какой из приведенных реакции тепловой эффект при Т = 298К равен этой величине?
А) С + О2 = СО2;
В) С + 1/2 О2 = СО;
С) СО + 1/2О2 = СО2;
D) 2С + 2Н2 = С2Н4;
Е) С + Н2О = СО + Н2.
$$$ 11
Стандартная теплота образования HCI 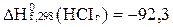 кДж/моль.
кДж/моль.
Чему равен стандартный тепловой эффект реакции?
2HCI(г) = H2 + CI2
А) -92,3 кДж/моль;
В) 92,3 кДж/моль;
С) 184,6 кДж/моль;
D) -184,6 кДж/моль;
Е) необходимы дополнительные данные.
$$$ 12
Закрытой системой называется система, которая......
А) обменивается с окружающей средой и веществом, и энергией;
В) не обменивается ни веществом, ни энергией с окружающей средой;
С) обменивается веществом и не обменивается энергией с окружающей средой;
D) имеет U = const;
Е) обменивается энергией и не обменивается веществом с окружающей средой.
$$$13
Для какого процесса справедлива формула:
qp = DH?
А) для изохорного;
В) для любого обратимого;
С) для адиабатического;
D) для изобарного;
Е) для изотермического.
$$$ 14
Как выражается тепловой эффект реакции ( 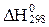 ) через стандартные теплоты образования веществ (
) через стандартные теплоты образования веществ ( 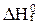 ):
):

 4Ag + О2 2Ag2O
4Ag + О2 2Ag2O
А) 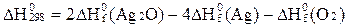 ;
;
В)  ;
;
С) 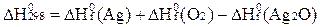 ;
;
D) 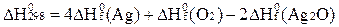 ;
;
Е) 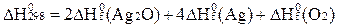 .
.
$$$ 15
Тепловой эффект реакции возрастает с увеличением температуры, если
А) DG < 0;
В) DG > 0;
С) DCp > 0;
D) DCp < 0;
Е) DH > 0.
$$$ 16
Стандартная энтальпия образования газообразной воды 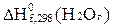 равна
равна
-241,84 кДж/моль, а жидкой воды 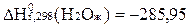 кДж/моль. Чему
кДж/моль. Чему
равна энтальпия фазового перехода ( процесса испарения):
Н2О(ж) ® Н2О(г) ?
А) 44,11 кДж/моль;
В) -44,11 кДж/моль;
С) 241,84 кДж/моль;
D) -285,95 кДж/моль;
Е) 527,79 кДж/моль.
$$$ 17
Открытой системой называется система, которая......
А) обменивается с окружающей средой и веществом, и энергией;
В) обменивается только веществом, но не обменивается энергией с окружа-
ющей средой;
С) обменивается только энергией, но не обменивается веществом с окружа-
ющей средой;
D) не обменивается ни веществом , ни энергией с окружающей средой;
Е) имеет Т = const и V = const.
$$$ 18
При экзотермическом процессе:
А) DН = 0;
В) DG = 0;
С) Т = const;
D) DН < 0;
Е) DH > 0.
$$$ 19
При каком процессе вся теплота, данная идеальному газу, превращается в работу его расширения? (q = A)
А) при адиабатическом;
В) при изобарном;
С) при изохорном;
D) при изотермическом;
Е) при любом обратимом.
$$$ 20
Как выражается тепловой эффект реакции 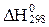 через теплоты образова-ния веществ (
через теплоты образова-ния веществ ( 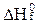 )? 2СО + S2 = 2COS
)? 2СО + S2 = 2COS
А) 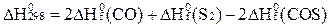 ;
;
B) 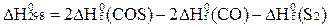 ;
;
C) 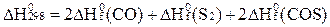 ;
;
D) 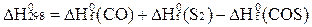 ;
;
Е) 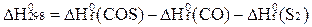 .
.
$$$ 21
Изолированной системой называется система, которая ....
А) обменивается с окружающей средой и энергией и веществом.
В) не обменивается ни энергией, ни веществом с окружающей средой.
С) обменивается энергией, но не обменивается веществом с окружающей средой.
D) обменивается веществом, но не обменивается энергией с окружающей средой.
Е) имеет T = const и P = const.
$$$ 22
При эндотермическом процессе
А) DН = 0;
В) DG = 0;
С) T = const;
D) D H < 0;
Е) D H > 0.
$$$ 23
Для какого процесса справедлива формула:
А = Сv (T1 - T2)?
А) для изотермического;
В) для изобарного;
С) для изохорного;
D) для любого обратимого;
Е) для адиабатического.
$$$ 24
Как выражается 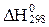 реакции через теплоты образования участвующих в ней веществ (
реакции через теплоты образования участвующих в ней веществ ( 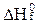 )?
)?
4Fe3O4 + O2 = 6Fe2О3
А)  ;
;
В) 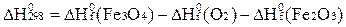 ;
;
С)  ;
;
D) 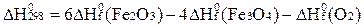 ;
;
Е)  .
.
$$$ 25
Стандартная теплота образования диокcида азота  кДж/моль. В какой из приведенных реакций тепловой эффект при Т = 298К равен этой величине?
кДж/моль. В какой из приведенных реакций тепловой эффект при Т = 298К равен этой величине?
А) N2 + 2O2 = 2NO2;
B) 2NO + O2 = 2NO2;
C) 1/2N2 + O2 = NO2;
D) NO + 1/2 O2 = NO2;
E) 4NH3 + 7O2 = 4NO2 + 6H2O.
$$$ 26
Какую размерность имеет энтропия 1 моля вещества?
А) Дж;
В) Дж/К;
С) Дж/моль;
D) Дж/моль К;
Е) Дж/кг.
$$$ 27
Адиабатный процесс, это процесс протекающий при....
А) T = const;
В) P = const;
С) dU = 0;
D) dA = 0;
Е) dq = 0.
$$$ 28
Для какого процесса справедлива формула?
qv = DU?
А) для изотермического;
В) для изохорного;
С) для изобарного;
D) для адиабатического;
Е) для любого обратимого.
$$$ 29
Как выражается 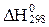 реакции через теплоты образования веществ (
реакции через теплоты образования веществ ( 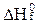 )?
)?
С + 2Н2О = СО2 + 2Н2
А)  ;
;
В)  ;
;
С) 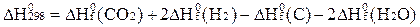 ;
;
D) 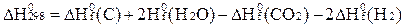 ;
;
Е)  .
.
$$$ 30
Тепловой эффект реакции уменьшается с увеличением температуры, если
А) DСр < 0;
В) D Ср > 0;
С) DН < 0;
D) DG < 0;
Е) D S < 0.
$$$ 31
Укажите какое уравнение связывает I и II законы термодинамики?
А) ТdS = dU + PdV;
В) dS = dq/T;
C) dq = dU + PdV;
D) dG =- SdT + VdP;
Е) dF = - TdS + PdV.
$$$ 32
Как изменяется температура кипения Н2О с ростом внешнего давления?
А) уменьшается;
В) не изменяется;
С) увеличивается;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 33
Каково поведение энтропии изолированной системы при протекании в ней самопроизвольных процессов?
А) всегда убывает;
В) всегда возрастает;
С) не изменяется;
D) может и возрастать и убывать;
Е) сначала возрастает, затем убывает.
$$$ 34
Как ведет себя энергия Гельмгольца вещества при его расширении при
Т = const?
А) возрастает;
В) убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 35
Какую функцию необходимо рассчитать, чтобы узнать, возможно ли данная реакция при Р и Т = const?
А)  ;
;
В)  ;
;
С) DG = D H – ТD S ;
D) D H = D U + D nRT;
Е) никакую из приведенных.
$$$ 36
Укажите уравнение зависимости теплового эффекта реакции от темпера-
туры:
А) dH = CpdT;
B) dD H/dT = DCp;
C) dq = TdS;
D) dU/dT = Cv;
Е) dq = dA + dU.
$$$ 37
Для каких процессов применимо уравнение Клаузиуса - Клапейрона вида:
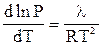 ?
?
А) для любых фазовых превращений;
В) для процесса плавления;
С) для процесса испарения;
D) для любых обратимых;
Е) для любых необратимых.
$$$ 38
Как изменяется энтропия при плавлении твердого тела и при испарении жидкости?
А) увеличивается в обоих случаях;
В) уменьшается в обоих случаях;
С) не изменяется;
D) увеличивается при плавлении и уменьшается при испарении;
Е) уменьшается при плавлении и увеличивается при испарении.
$$$ 39
При постоянных V и Т самопроизвольные процессы протекают, если
А) возрастает энтропия (D S>0);
В) убывает энергия Гиббса (DG <0);
С) возрастает энтальпия (DН >0);
D) возрастает энергия Гельмгольца (D F > 0);
Е) убывает энергия Гельмгольца (DF < 0).
$$$ 40
Как изменяется энтропия при увеличение давления при T = const?
А) возрастает;
В) убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 41
Рассчитать DG, если DH = 20,0 кДж, DS = 100 Дж, а Т = 300К?
А) -10 кДж;
В) 30 кДж;
С) 50 кДж;
D) -0,67 кДж;
Е) -600 кДж.
$$$ 42
Как изменяются температуры кипения и замерзания воды с ростом давления?
А) не изменяются;
В) увеличиваются;
С) уменьшаются;
D) температура кипения увеличивается, а температура замерзания уменьшается;
Е) температура кипения уменьшается, а температура замерзания увеличивается;
$$$ 43
Для каких процессов справедливо соотношение: DS = q/T ?
А) для любых;
В) для любых изотермических;
С) для любых обратимых;
D) для обратимых изотермических;
Е) ни для каких из приведенных.
$$$ 44
Какая из приведенных функции служит критерием равновесия в системе при Р и Т = const?
А) энергия Гельмгольца (F);
В) энтропия (S);
С) энтальпия (H);
D) внутренняя энергия (U);
Е) энергия Гиббса (G).
$$$ 45
Как ведет себя энергия Гельмгольца при нагревании при V = const?
А) возрастает;
В) убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 46
Чему равно DSкип одного моля вещества, если его DНисп = 30,0 кДж/моль, Ткип=300К?
А) 10 кДж/К;
В) 0,1 кДж/К;
С) 90000 кДж/К;
D) 270 кДж/К;
Е) 330 кДж/К.
$$$ 47
Как изменяется температура плавления железа и висмута с ростом давления?
А) не изменяется в обоих случаях;
В) увеличивается в обоих случаях;
С) уменьшается в обоих случаях;
D) увеличивается для железа и уменьшается для висмута;
Е) уменьшается для железа и увеличивается для висмута.
$$$ 48
Для какой системы изменение энтропии позволяет установить направление самопроизвольных процессов?
А) открытой;
В) закрытой;
С) любой;
D) изолированной;
Е) ни для какой из выше указанных.
$$$ 49
Состояние равновесия в системе при Р и Т = const характеризуется следующим соотношением:
А) DS = 0;
В) DG < 0;
С) DG > 0;
D) DF = 0;
Е) DG = 0.
$$$ 50
Как ведет себя энергия Гиббса вещества при его нагревании при Р = const?
А) всегда возрастает;
В) всегда убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 51
По какому из графиков можно определить теплоту испарения?
 A)
A)
B)
 |
C)

 D)
D)
E)

$$$ 52
Какой из перечисленных ниже наборов термодинамических данных нужно найти в справочнике для расчета Кр химической реакции при заданной температуре, используя приближенное уравнение Кирхгоффа?
А)  и
и 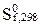 продуктов реакции;
продуктов реакции;
В)  и
и 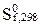 всех веществ;
всех веществ;
С)  и
и 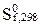 , Ср продуктов реакций;
, Ср продуктов реакций;
D)  и
и 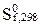 , Ср всех веществ;
, Ср всех веществ;
Е)  , Ср - всех веществ.
, Ср - всех веществ.
$$$ 53
Найдите константу равновесия следующей реакции:

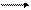 H2 + J2 2HJ
H2 + J2 2HJ
если равновесные концентрации веществ следующие: C(HJ) =0,03 моль/л,
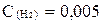 моль/л,
моль/л,  моль/л.
моль/л.
А) 1200;
В) 0,028;
С) 30;
D) 36;
Е) 0,009.
$$$ 54
От каких факторов зависит константа равновесия КС ?
А) только от температуры;
В) только от концентрации веществ;
С) только от природы веществ;
D) от температуры и концентрации;
Е) от температуры и природы веществ.
$$$ 55
Укажите правильную формулу связи между Кр и Кс гетерогенной реакции
Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(г)
А) KP = KC(RT);
В) KP = KC(RT)2;
С) КР = КС;
D) KP = KC /(RT);
Е) KP = KC /(RT)2.
$$$ 56
Как изменятся константы равновесия Кх следующих реакции при увеличении давления?

 1) 2C(т) + О2 2СО
1) 2C(т) + О2 2СО

 2) 2NO + O2 2NO2
2) 2NO + O2 2NO2
А) Кх(I) - увеличивается; Кх (2) - уменьшается;
В) Кх(I) - увеличивается; Кх (2) - не изменяется;
С) Кх(I) - уменьшается; Кх (2) - увеличивается;
D) Обе константы не изменяется;
E) Обе константы увеличивается.
$$$ 57
Найдите константу равновесия следующей реакции:
 2SO2 + O2 2SO3
2SO2 + O2 2SO3
если равновесные концентрации веществ следующие: 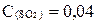 моль/л,
моль/л, 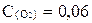 моль/л;
моль/л; 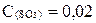 моль/л.
моль/л.
А) 8,33;
В) 4,17;
С) 0,24;
D) 0,12;
Е) 5,0.
$$$ 58
Укажите правильную запись для константы равновесия гетерогенной
реакции

 SiH4(г) Si(т) + 2 H2(г)
SiH4(г) Si(т) + 2 H2(г)
А)  ;
;
В) 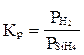 ;
;
С) 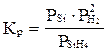 ;
;
D) 
Е) 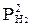 .
.
$$$ 59
Если тепловой эффект реакции равен нулю (DH = 0), то как изменяются Кр и
Кс с ростом температуры?
А) увеличиваются;
В) уменьшаются;
С) не изменяются;
D) Кр уменьшается; Кс увеличивается
Е). Кс уменьшается; Кр увеличивается
$$$ 60
Укажите правильную формулу связи между КР и КС гетерогенной реакций

 4Ag2(т) + O2 2 Ag2O(т)
4Ag2(т) + O2 2 Ag2O(т)
А) КР = КС;
В) KP = KC(RT);
С) KP = KC(RT)-3;
D) KP = KC /RT;
Е) KP = KC(RT)2 .
$$$ 61
Как изменится константа равновесия Кх следующих реакции при увеличении давления?

 1) N2O4 2NO2
1) N2O4 2NO2
 2) 6C(т) + 3H2(г) C6H6(г)
2) 6C(т) + 3H2(г) C6H6(г)
А) Кх(1) - уменьшается; Кх(2) - увеличивается;
В) Кх(1) - увеличивается; Кх(2) - уменьшается;
С) Кх(1) и Кх(2) - увеличиваются;
D) Кх(1) и Кх(2) - уменьшаются;
Е) Кх(1) и Кх(2) - не изменяются.
$$$ 62
Найдите константу равновесия следующей реакции:

 СО + CI2 COCI2
СО + CI2 COCI2
если равновесные концентрации веществ равны:
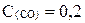 моль/л,
моль/л,  моль/л,
моль/л, 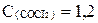 моль/л.
моль/л.
А) 2,4;
В) 0,42;
С) 36;
D) 24;
Е) 20.
$$$ 63
Укажите правильную запись для константы равновесия гетерогенной реакции:
Са(т) + 2СН4(г) = СаС2(т) + 4Н2
А) 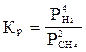 ;
;
В) 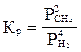 ;
;
С)  ;
;
D)  ;
;
Е)  .
.
$$$ 64
От чего зависит константа равновесия Кр химической реакции?
А) от общего давления;
В) от температуры;
С) от парциальных давлений веществ;
D) от температуры и общего давления;
Е) от парциальных давлений веществ и температуры.
$$$ 65
Укажите правильную формулу связи между КР и КС гетерогенной реакции
С(т) + 2H2О = СО2 + 2H2
А) KP = KC /RT2;
В) KP = KC /(RT)2;
С) КР = КС;
D) KP = KC (RT);
Е) KP = KC /RT;
$$$ 66
Как изменится константа равновесия Кх следующих реакции при увеличении давления?
1) СO + CI2 = COCI2
2) 2H2 + O2 = 2H2O
А) Кх(1) - уменьшается; Кх(2) - увеличивается;
В) Кх(1) - увеличивается; Кх(2) - уменьшается;
С) Кх(1) и Кх(2) - увеличиваются;
D) Кх(1) и Кх(2) - уменьшаются;
Е) Кх(1) и Кх(2) - не изменяются.
$$$ 67
Найдите константу равновесия Кс следующей реакции:

 N2 + 3H2 2NH3
N2 + 3H2 2NH3
если равновесные концентрации веществ равны:
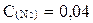 моль/л,
моль/л,  моль/л,
моль/л, 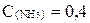 моль/л.
моль/л.
А) 4000;
В) 100;
С) 0,00025;
D) 0,001;
Е) 24,8.
$$$ 68
Укажите правильную запись уравнения изотермы Вант-Гоффа для реакции:
Fe2O3 + CO = 2FeO + CO2
A) 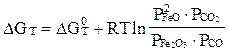 ;
;
B)  ;
;
C) 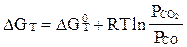 ;
;
D) 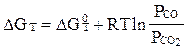 ;
;
E)  .
.
$$$ 69
Как изменяется Кр с ростом температуры, если данная реакция эндотермическая (DН > 0)?
А) возрастает;
В) убывает;
С) не изменяется;
D) сначала возрастает, затем не изменяется;
Е) сначала убывает, затем не изменяется.
$$$ 70
Укажите формулу связи между КР и КС гетерогенной реакции

 С(т) + 2Н2 СН4
С(т) + 2Н2 СН4
А) KP = KC;
В) KP = KC(RT)2 ;
С) KP = KC(RT)-1;
D) KP = KC(RT)3;
Е) КР = КС / (RT)2.
$$$ 71
Как изменится константа равновесия Кх следующих реакций при
увеличении давления?

 1) 2SO2 + O2 2SO3
1) 2SO2 + O2 2SO3

 2) Br2 + H2 2HBr
2) Br2 + H2 2HBr
А) Кх(1) - увеличивается; Кх(2) - уменьшается;
В) Кх(1) - увеличивается; Кх(2) - не изменяется;
С) Кх(1) - уменьшается; Кх(2) - увеличивается;
D) обе константы не изменяются;
Е) обе константы увеличиваются.
$$$ 72
Найдите константу равновесия Кс реакции:

 H2 + J2 2HJ
H2 + J2 2HJ
если равновесные концентрации веществ следующие: C(HJ) =0,5 моль/л,
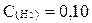 моль/л,
моль/л, 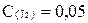 моль/л.
моль/л.
А) 12;
В) 3,33;
С) 0,01;
D) 0,02;
Е) 50.
$$$ 73
Как изменяется константа равновесия химической реакции с ростом температуры, если реакция идет с выделением тепла (DН < 0)?
A) не изменяется;
B) растет;
C) уменьшается;
D) сначала уменьшается, затем не изменяется;
Е) растет, затем не изменяется.
$$$ 74
Укажите формулу связи между КР и КС гетерогенной реакции
С2 Н4 + SO2 = 2С(т) + 2H2S
А) KP = KC(RT)-2;
В) КР = КС;
С) KP = KC(RT)-1;
D) KP = KC(RT)2;
Е) KP = KC (RT).
$$$ 75
Как изменится константа равновесия Кх следующих реакции при увеличении давления?
1) С2 Н4 (г) + Н2(г) = С2Н6(г)
2) N2 + O2 = 2NO
А) обе константы не изменяются;
В) обе константы увеличиваются;
С) Кх(1) - увеличивается; Кх(2) - уменьшается;
D) Кх(1) - увеличивается; Кх(2) - не изменяется;
Е) Кх(1) - не изменяется; Кх(2) - увеличивается.
$$$ 76
Какова масса NaOH (M=40 г/моль), находящегося в растворе объемом 0,5 л, если концентрация (NaOH) = 0,1 моль/л?
А) 4 г;
В) 40 г;
С) 20 г;
D) 2 г;
Е) 0,2 г.
$$$ 77
Имеется летучий растворитель (I), разбавленный раствор летучего вещества (II) и разбавленный раствор нелетучего вещества (III) той же концентрации. В каком соотношении будут находиться температуры кипения этих жидкостей?
А) Т1 >Т2>Т3;
В) Т2 < Т1 < Т3 ;
C) Т1 <Т2<Т3;
D) Т1 = Т2 = Т3;
E) Т3 < Т1 < Т2 .
$$$ 78
От каких параметров зависит коэффициент распределения?
А) от концентрации третьего компонента;
В) только от температуры;
С) от температуры и природы веществ;
D) от концентрации третьего компонента и природы веществ;
Е) только от природы вещества.
$$$ 79
Определите температуру кипения и замерзания раствора сахара в воде, если концентрация сахара 2 моль/кг.
(Ек = 0,520; Eз = 1,860)
А) 100,520С; - 1,860С;
В) 1,040С; - 3,720С;
С) 98,960С; +3,720С;
D) 101,040С; - 3,720С;
Е) 101,040С; 3,720С.
$$$ 80
Первое следствие закона Рауля имеет математическое выражение:
А) DТк = Екв;
В) вi = ni/m;
C) 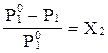 ;
;
D) к = С1/С2;
Е) Р1 = 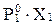 .
.
$$$ 81
Найти массовую долю NaCI в растворе, содержащем 30 г NaCI и 120 г H2O.
А) 2,5%;
В) 2,0%;
С) 4%;
D) 25%;
Е) 20%.
$$$$ 82
Укажите формулу, описывающую закон Рауля:
А) Р2 = К/С2;
В) К = С1/С2;
С) 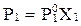 ;
;
D) PV = nRT;
E) P1/P2 = V2/V1.
$$$ 83
Чему равны температура кипения и температура замерзания раствора глицерина в воде, (в = 1,5 моль/кг) (эбуллиоскопическая постоянная воды 0,520, а криоскопическая постоянная воды 1,860)?
А) 0,780С; 2,790С;
В) 100,780С; 2,790С;
С) 99,220С; -2,790С;
D) 100,780С; -2,790С;
Е) 99,220С; 2,790С.
$$$ 84
Какова моляльная концентрация раствора, приготовленного из 20 г NaOH и 500 г Н2О (MNaOH = 40 г/моль)?
А) 2 моль/кг;
В) 0,04 моль/кг;
С) 4 моль/кг;
D) 1 моль/кг;
Е) 0,001 моль/кг.
$$$ 85
Как изменяется энтропия (S),объем (V), энергия Гиббса (G) при образовании идеального раствора?
А) DS < 0; DV > 0; DG < 0;
B) DS > 0; DV < 0; DG > 0;
C) DS > 0; DV = 0; DG > 0;
D) DS > 0; DV = 0; DG < 0;
E) DS = 0; DV > 0; DG < 0.
$$$ 86
Kак изменяется растворимость газа в жидкости с увеличением давления газа и температуры?
А) увеличивается в обоих случаях.
В) Уменьшается в обоих случаях.
С) Не изменяется.
D) Увеличивается с увеличением давления и уменьшается с увеличением температуры.
Е) Уменьшается с увеличением давления и увеличивается с ростом
температуры.
$$$ 87
Чему равны температура кипения и температура замерзания раствора йода в бензоле, если концентрация йода (J2) = 1 моль/кг, а температура кипения бензола tk = 780С и температура замерзания бензола tз = 5,50С?
(Еэ = 2,40; Eк = 5,10)
А) 80,40С; 5,10С;
В) 80,40С; 0,40С;
С) 80,40С; 10,60С;
D) 75,60С; 0,40С;
Е) 75,60С; 10,60С.
$$$ 88
Укажите формулу, выражающую закон Вант-Гоффа об осмотическом давлении:
А) 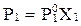 ;
;
В)  ;
;
С) С2 = КР2;
D) DТз = Кзв;
Е) p = СRT.
$$$ 89
Как называется концентрация, выражаемая формулой:
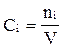 ?
?
А) моляльная;
В) молярная;
С) молярная доля;
D) объемная доля;
Е) массовая доля.
$$$ 90
Молярная концентрация СКОН = 2 моль/л. Сколько нужно взять КОН, чтобы приготовить 0,5 л раствора? (МКОН = 56 г/моль)
А) 28 г;
В) 112 г;
С) 56 г;
D) 40 г;
Е) 2,8 г.
$$$ 91
Укажите формулу, выражающую закон Генри?
А) 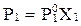 ;
;
В)  ;
;
С) С2 = КР2;
D) DТз = Кзв;
Е) p = СRT.
$$$ 92
Как изменяется давление насыщенного пара растворителя над раствором с увеличением концентрации растворенного вещества (Х2) и растворителя (Х1).
А) не изменяется;
В) увеличивается с увеличением Х2 и уменьшается с увеличением Х1;
С) увеличивается с увеличением Х1 и уменьшается с увеличением Х2;
D) увеличивается в обоих случаях;
Е) уменьшается в обоих случаях.
$$$ 93
Как называется концентрация, выражаемая формулой:
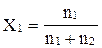 ?
?
А) молярная;
В) моляльная;
С) молярная доля;
D) объемная доля;
Е) массовая доля.
$$$ 94
Укажите формулу, выражающую закон распределения Нернста-Шилова:
А) 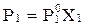 ;
;
В) К = С1/С2;
С) С2 = КР2;
D) DТз = Езв;
Е) p = cRT.
$$$ 95
80 г NaOH (М = 40 г/моль) растворено в 144 г Н2О. Найти молярную долю Х (NaOH) и Х(Н2О) в этом растворе.
А) 0,8; 0,2;
В) 0,2; 0,8;
С) 0,25; 0,75;
D) 0,75; 0,25;
Е) 0,2; 0,2.
$$$ 96
Какие из следующих утверждений:
1) закон Рауля соблюдается для каждого компонента раствора 
2) DVсмеш. = 0;
3) DSсмеш. = 0;
4) DGсмеш. = 0;
5) DHсмеш. = 0.
справедливы для идеального раствора?
А) 1), 2), 4);
В) 2), 3), 4), 5);
С) 1), 2), 5);
D) 1), 2), 3);
Е) 3), 4), 5).
$$$ 97
Какие из следующих пар газов подчиняются закону Генри?
А) CH4 и N2;
В) HCI и N2;
С) CO2 и O2;
D) NH3 и H2;
Е) HCI и CO.
$$$ 98
Какова концентрация сахара в воде, если температура кипения этого раствора 100,260С, а эбуллиоскопическая постоянная воды 0,520?
А) 1 моль/кг;
В) 2 моль/кг;
С) 0,1 моль/кг;
D) 0,5 моль/кг;
Е) 0,05 моль/кг.
$$$ 99
Как называется концентрация, выражаемая формулой:
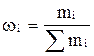 ?
?
А) моляльная;
В) молярная;
С) молярная доля;
D) объемная доля;
Е) массовая доля.
$$$ 100
Определите вариантность системы (С), состоящей из раствора К2SO4 и Na2SO4 в воде, в присутствии паров воды и кристаллов обеих солей?
А) 0;
В) 1;
С) 2;
D) 3;
Е) 4.
$$$ 101
Сколько фаз и какие находятся в равновесии в т. К на диаграмме состояния воды?

А) три фазы - жидкость, пар, лед.
В) две фазы - жидкость и пар.
С) одна фаза - пар.
D) две фазы - жидкость и лед.
Е) две фазы - лед и пар.
$$$ 102
 Какие фазы находятся в равновесии в условиях, обозначенных т. М?
Какие фазы находятся в равновесии в условиях, обозначенных т. М?
А) расплав;
В) кристаллы А, кристаллы В и расплав;
С) кристаллы А и расплав;
D) кристаллы В и расплав;
Е) кристаллы А и кристаллы В.
$$$ 103
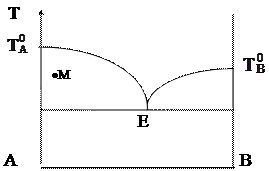
Укажите правильную кривую охлаждения.
 |
А) Кривая I ;
В) Кривая II;
С) Кривая III;
D) Кривая IV;
Е) Кривая V.
$$$ 104
Что понимают под термином «число степеней свободы» (вариантность)
системы?
А) число независимых параметров, которые можно изменять, не изменяя
числа фаз в системе;
В) число независимых параметров в системе;
С) число индивидуальных веществ, входящих в систему, за вычетом числа
химических уравнений, связывающих эти вещества.
D) число индивидуальных веществ в газовой фазе.
Е) число индивидуальных веществ в конденсированных фазах.
$$$ 105
Сколько фаз находится в т. М и в т. L на диаграмме Алексеева?
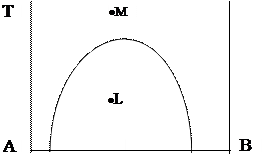
А) в т. М и в т. L -одна фаза;
В) в т. Mа - две фазы, в т. L - две фазы;
С) в т. M - одна фаза, в т. L - две фазы;
D) в т. M - две фазы, в т. L - одна фаза;
Е) в т. M - две фазы, в т. L - три фазы.
$$$ 106
Сколько фаз и какие находятся в т. К на диаграмме состояния воды?
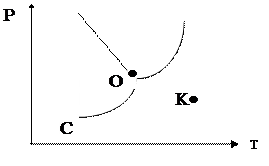
А) одна фаза - пар;
В) одна фаза - жидкость;
С) одна фаза - лед;
D) две фазы - пар и жидкость;
Е) две фазы - лед и пар.
$$$ 107
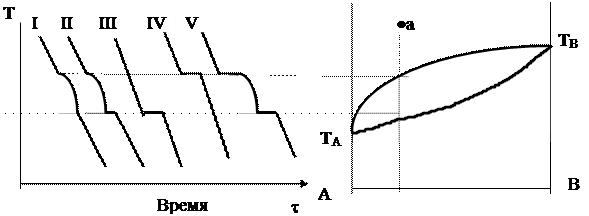
Какие фазы находятся в равновесии в условиях, обозначенных т. М и т. N?
 |
А) в т. М - жидкий расплав; в т. N - кристаллы А и жидкий расплав;
В) в т. М - жидкий расплав; в т. N - кристаллы А, В и жидкий расплав;
С) в т. М - расплав; в т. N - твердый раствор А и В и жидкий расплав;
D) в т. М - твердый раствор А и В и жидкий расплав; в т. N - жидкий расплав;
Е) в т. М - жидкий расплав; в т. N - твердый раствор А и В.
$$$ 108
Как называется точка на диаграмме плавкости, в которой из жидкого расплава происходит кристаллизация двух твердых фаз одновременно?
А) эвтектическая;
В) перитектическая;
С) критическая;
D) азеотропная;
Е) фигуративная.
$$$ 109
Что понимают под термином «число компонентов» в правиле фаз Гиббса?
А) число индивидуальных веществ, входящих в систему;
В) число индивидуальных веществ, входящих в систему за вычетом числа уравнений, связывающих концентрации этих веществ;
С) число индивидуальных веществ в газовой фазе;
D) число индивидуальных веществ в конденсированной фазе;
Е) число индивидуальных веществ за вычетом числа фаз в системе.
$$$ 110
Из жидкого расплава свинца и сурьмы, частично выпали кристаллы сурьмы. Сколько степеней свободы имеет такая система при Р = const?
А) 0;
В) 1;
С) 2;
D) 3;
Е) 4.
$$$ 111
Как называется линия, изображающая на диаграмме состояния зависимость температуры начала кристаллизации от состава двухкомпонентной смеси?
А) солидуса;
В) ликвидуса;
С) расслоения;
D) нода;
Е) кипения.
$$$ 112
Какая линия на диаграммах состояния называется «нодой»?
А) кривая, выше которой находится только жидкая фаза;
В) линия, ниже которой находится только твердые фазы;
С) кривая зависимости температуры системы от времени;
D) кривая, выше которой находится только пар;
Е) прямая, соединяющая точки равновесных фаз.
$$$ 113
Какие фазы находятся в равновесии в условиях обозначенных т. L?
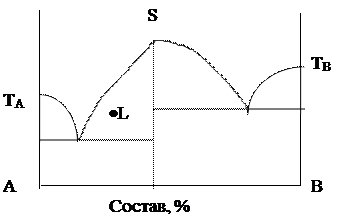
А) кристаллы А, и расплав;
В) кристаллы химического соединения S, кристаллы А и расплав;
С) кристаллы химического соединения S, расплав;
D) кристаллы В и расплав;
Е) кристаллы химического соединения S, кристаллы В и расплав.
$$$ 114
Укажите молекулярность приведенной ниже реакции:
2NO + Br2 = 2NOBr
А) 1;
В) 2;
С) 3;
D) 4;
Е) 5.
$$$ 115
Укажите молекулярность приведенной ниже реакции:
CH3COCH3 = C2H5 + CO + H2
А) 1;
В) 2;
С) 3;
D) 4;
Е) 5.
$$$ 116
Укажите молекулярность приведенной ниже реакции:
2N2O5 = 2N2O4 + O2
А) 1;
В) 2;
С) 3;
D) 4;
Е) 5.
$$$ 117
Укажите молекулярность приведенной ниже реакции:
H2 + J2 = 2HJ
А) 1;
В) 2;
С) 3;
D) 4;
Е) 5.
$$$ 118
Как изменится константа скорости реакции
СН3СОСН3 = С2Н4 + СО + Н2
если концентрацию исходного вещества увеличить в 2 раза?
А) не изменится;
В) увеличится в 2 раза;
С) уменьшится в 2 раза;
D) увеличится в 4 раза;
С) уменьшится в 4 раза.
$$$ 119
Как изменится скорость реакции
Н2 + J2 = 2HJ
если концентрации исходных веществ увеличить в 2 раза?
А) увеличится в 2 раза;
В) не изменится;
С) уменьшится в 2 раза;
D) увеличится в 4 раза;
E) уменьшится в 4 раза.
$$$ 120
Как изменится скорость реакции
2СО + О2 = 2СО2 ,
если концентрации исходных веществ увеличить в 2 раза?
А) не изменится;
В) увеличится в 2 раза;
С) увеличится в 4 раза;
D) увеличится в 8 раз;
С) уменьшится в 2 раза.
$$$ 121
Как изменится скорость реакции: N2 + 3H2 = 2NH3,
если концентрацию Н2 увеличить в 2 раза?
А) увеличится в 2 раза;
В) уменьшится в 2 раза;
С) не изменится;
D) увеличится в 8 раз;
Е) увеличится в 6 раз.
$$$ 122
k = 0,3 л/мол×мин. Укажите порядок реакции.
А) 0;
В) 1;
С) 2;
D) 3;
Е) 1/2.
$$$ 123
k = 2,3 сек-1. Укажите порядок реакции.
А) 0;
В) 1;
С) 2;
D) 3;
Е) 1/2.
$$$ 124
k = 8,9 л2/моль2×мин. Укажите порядок реакции.
А) 0;
В) 1;
С) 2;
D) 3;
Е) 1/2.
$$$ 125
Для реакции первого порядка при С0 = 1 моль/л t1/2 = 500С. Каково
значение t1/2 при С0 = 2 моль/л?
А) 250 с.;
В) 1000 с.;
С) 500 с.;
D) 50 с.;
Е) 100 с.
$$$ 126
Как изменится период полураспада для реакции второго порядка, если
исходная концентрация увеличится в 2 раза?
А) увеличится в 2 раза;
В) уменьшится в 2 раза;
С) увеличится в 4 раза;
D) уменьшится в 4 раза;
Е) не изменится.
$$$ 127
Как изменится период полураспада для реакции третьего порядка, если исходная концентрация увеличится в 2 раза?
А) увеличится в 2 раза;
В) уменьшится в 2 раза;
С) уменьшится в 4 раза;
D) уменьшится в 8 раз;
Е) увеличится в 8 раз.
$$$ 128
Какое из приведенных ниже уравнений является уравнением Аррениуса?
А) -dc/dt = kc;
В) k = Ae-E/RT;;
С) u = - dc/dt;
D) 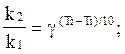
Е) 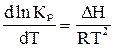 .
.
$$$ 129
Зависят ли константа скорости и скорость реакции от температуры и концентрации ?
А) зависят;
В) не зависят;
С) скорость зависит только от концентрации, а константа скорости только от
температуры;
D) скорость зависит от концентрации и температуры, а константа скорости только от температуры;
Е) скорость зависит только от температуры, а константа скорости от
температуры и концентрации.
$$$ 130
Могут ли порядок реакции и молекулярность быть дробными величинами?
А) не могут;
В) могут;
С) порядок может, молекулярность нет;
D) молекулярность может, порядок нет;
Е) могут, если это сложная реакция.
$$$ 131
Во сколько раз увеличится скорость реакции, если температура возрастет
на 200, а g = 2?
А) в 2 раза;
В) в 3 раза;
С) в 4 раза;
D) в 6 раз;
Е) в 8 раз.
$$$ 132
Как изменится скорость реакции, если температуру увеличить от 295К до
325К, а коэффициент Вант-Гоффа равен g = 3?
А) в 3 раза увеличится;
В) в 9 раз уменьшится;
С) в 9 раз увеличится;
D) в 27 раз уменьшится;
Е) в 27 раз увеличится.
$$$ 133
Что называется энергией активации?
А) количество энергии, выделяющейся (или поглощающейся) при образовании 1 моля продукта;
В) общее количество энергии соударяющихся молекул;
С) избыточная энергия по сравнению со средней энергией, которой должны
обладать молекулы, чтобы между ними произошла химическая реакция;
D) внутренняя энергия системы;
Е) средняя энергия молекул при взаимодействии.
$$$ 134
Чему равен коэффициент Вант-Гоффа, если при увеличении температуры на 400 скорость реакции возросла в 16 раз?
А) g = 2;
В) g = 1;
С) g = 3;
D) g = 4;
Е) g = 1,4.
$$$ 135
Чему равен изотонический коэффициент (i) раствора FeCI3, если a = 0,5?
А) 4;
В) 3;
С) 2,5;
D) 1,5;
E) 0,5.
$$$ 136
Как зависят степень (a) и константа диссоциации (КД) слабого электролита от концентрации (С)?
А) ни a, ни КД не зависят от С;
В) с увеличением С a и КД уменьшаются;
С) с увеличением С a и КД увеличиваются;
D) с увеличением С a уменьшается, КД остается постоянной;
E) с увеличением С a остается постоянной, а КД увеличивается.
$$$ 137
Определите константу диссоциации бинарного электролита КА, если его концентрация в растворе 1 моль/л, а степень диссоциации 0,6.
А) 0,9;
В) 0,6;
С) 0,4;
D) 0,2;
E) 0,1.
$$$ 138
Чему равен изотонический коэффициент (i) раствора Na2SO4, если a = 0,8?
А) 2,6;
В) 3:
С) 1,8:
D) -1,6:
E) 3,4.
$$$ 139
Чему равен изотонический коэффициент (i) бесконечно разбавленного раствора CuCI2 ?
А) 0;
В) 1;
С) 2;
D) 3;
E) 4.
$$$ 140
Чему равен рОН раствора Са(ОН)2 с концентрацией С= 0,5 моль/л; a = 0,1?
А) 0;
В) 1;
С) 2;
D) 3;
E) 4.
$$$ 141
Чему равен рН раствора СН3СООН, если С= 0,1 моль/л; a = 0,001?
А) 0,1;
В) 0,01;
С) 2;
D) 3;
E) 4.
$$$ 142
Активность ионов водорода равна 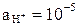 . Чему равен рН и какая это среда?
. Чему равен рН и какая это среда?
А) рН =7-нейтральная;
В) рН = 5 –кислая;
С) рН = 9-щелочная;
D) рН = 10-5-щелочная;
Е) рН = 10-9 –кислая.
$$$ 143
Если j1 = -1,2В, j2 = 0,8В, то ЭДС гальванического элемента равна:
А) Е == 0,4В;
В) Е = 0,96В;
С) Е = -2,0В;
D) Е = -0,4В;
Е) Е = 2,0В.
$$$ 144
Какой из электродов относится к электродам первого рода?
А) Pt(H2)/H+;
В) Ag/AgCI/KCI;
С) Pb/H2SO4;
D) Ag/AgNO3;
Е) Pt/Fe3+,Fe2+.
$$$ 145
С увеличением концентрации эквивалентная электропроводность (l)
А) уменьшается;
В) увеличивается;
С) не изменяется;
D) сначала увеличивается, затем уменьшается;
Е) сначала уменьшается, затем увеличивается.
$$$ 146
Чему равен потенциал стандартного водородного электрода:
 ?
?
А) 1;
В) -1;
С) 0;
D) 0,5;
Е) -0,5.
$$$ 147
С увеличением концентрации удельная электропроводность растворов (c)
А)уменьшается
В) увеличивается;
С) не изменяется;
D) сначала увеличивается, затем падает;
Е) сначала уменьшается, затем увеличивается.
$$$ 148
Какой электрод относится к электродам второго рода?
А) Pt(H2)½H+;
В) Ag½AgCI½CI- ;
С) Ag½Ag+ ;
D) Zn½Zn2+;
Е) Pt½Fe3+,Fe2+.
$$$ 149
Удельное сопротивление связано с эквивалентной электрической проводимостью следующей формулой:
А)  ;
;
В) 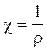 ;
;
С)  ;
;
D) 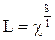 ;
;
Е) l = a×l¥ .
$$$ 150
Какой из гальванических элементов не относится к концентрационным?
A) Zn½Zn2+½½Ag+½Ag
В) Zn½Zn2+½½Zn2+½Zn
С) Pt(H2)½H+½(H2)Pt
D) Cd(Hg)½Cd2+½(Hg)Cd
Е) Ag½Ag+½½Ag+½Ag
$$$ 151
Определите рН раствора и его среду, если известна концентрация ионов водорода:  .
.
А) рН = 11 - щелочная;
В) рН = 3 - кислая;
С) рН = 3 - щелочная;
D) рН = 7 - кислая;
Е) рН = 11 - нейтральная.
$$$ 152
В гальваническом элементе электродные потенциалы равны:
j1 = 0,54B, j2 = -0,73B. Рассчитать ЭДС.
А) Е = j1 - j2 = 1,27B;
В) Е = j1 / j2 = - 0,74B;
С) Е = j1 + j2 = -0,19B;
D) Е = j1 / j2 = -1,35B;
Е) Е = j2 - j1 = -1,27B.
$$$ 153
Aктивность ионов гидроксила равна 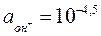 . Чему равен рН и какая это среда?
. Чему равен рН и какая это среда?
А) рН= 4.5 - кислая;
В) рН = 9,5 - кислая;
С) рН = -4,5 - щелочная;
D) рН = 9,5 - щелочная;
Е) рН = 10-4,5 – кислая.
$$$ 154
Какая из формул выражает закон Кольрауша?
А) c = lr;
B) l = cV;
С) c= 1/r;
D) a = lv/l¥;
Е) l¥ = la + lk.
$$$ 155
В гальваническом элементе электродные потенциалы равны:
j1 = 0,5 В и j2 = - 0,73 В, рассчитайте ЭДС.
А) Е = -1,26 В;
В) Е = 0,23 В;
С) Е = 1,26 В;
D) Е = -0,23 В;
Е) Е = - 0,365 В.
$$$ 156
В гальваническом элементе
-Pt(H2)/H+ (aH+=1)// Cu2+/Cu+
при Т = 298 К и Р = 1,013 Н/м2 ЭДС равна 0,34 В.
Чему равен потенциал медного электрода?
А) j = -0,34 В
В) j = - 0,66 В
С) j = 0,34 В
D) j = 0,66 В
В) j = 0.
$$$ 157
Количество диссоцированного вещества в 0,05М растворе NaCI равно
0,025 моль/л. Определите степень диссоциации вещества.
А) 0,05;
В) 0,50;
С) 0,025;
D) 0,00125;
В) 2.
$$$ 158
Определите рН 0,01М раствора СН3СООН, если степень диссоциации молекул кислоты 10%.
А) 3;
В) 2;
С) 1;
D) 0,5;
Е) 0,2.
$$$ 159
Чему равна ионная сила 0,02 М раствора CaCI2 ?
А) 0,005;
В) 0,02;
С) 0,01;
D) 0,03;
Е) 0,06.
$$$ 160
Потенциал катода гальванического элемента равен j2 = - 0,73 в, а анода
- j1 = 0,5 В. Рассчитайте ЭДС элемента.
А) 0,23 B;
В) - 0,23 B;
С) -1,23B;
D) 1,23B;
Е) - 0,365 B.
$$$ 161
Потенциал хлор-серебрянного электрода определяется следующим уравнением:
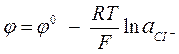
К какому типу относится данный электрод?
А) I рода;
В) концентрационный;
С) окислительно-восстановительный;
D) Ш рода;
Е) II рода.
$$$ 162
Потенциал катода гальванического элемента равен j1 = - 0,32 В,
а анода - j2 = - 0,70 В. Рассчитайте ЭДС элемента.
А) - 1,02 В;
В) - 0,38 В;
С) 0,38 В;
D) 1,02 В;
Е) 0,224 В.
$$$ 163
Гальванический элемент имеет следующую формулу:
(-) Zn / Zn2+) // Cu2+/ Cu (+)
Активности ионов и стандартные электродные потенциалы электродов равны:
а(Zn2+) = 0,01 моль/л и а(Cu2+) = 0,01 моль/л,
j0(Cu2+/Cu) = + 0,34 В j0(Zn2+/Zn) = - 0,76 В.
Рассчитайте ЭДС элемента при Т=298 K и Р=1 атм.
А) -0,42 В
В) 1,1В
С) -1,1 В
D) 2,26 В
E) -0,84 В.
$$$ 164
Определите физический смысл iв уравнении i = 1 + a(n-1)
А) стехиометрический коэффициент;
В) число атомов, входящих в состав молекулы электролита;
С) число ионов, образующихся при диссоциации молекулы электролита;
D) степень диссоциации электролита;
Дата добавления: 2014-11-30; просмотров: 1863;
