Лекция №10: Теория электролитической диссоциации. Электролиты.
Электролитами являются вещества, которые способны проводить электрический ток в растворах или расплавах. Электролиты можно классифицировать как проводники II рода. Они представляют собой вещества, распадающиеся в растворах или расплавах на ионы. Электролитами могут быть соли, кислоты и основания. Сам процесс диссоциации молекул слабых электролитов на ионы является обратимым.
Предположение Сванте Аррениуса о том, что причиной крайне высокого осмотического давления растворов электролитов является диссоциация этих электролитов на ионы, в дальнейшем было положено в основу теории электролитической диссоциации. В соответствии с этой теорией, растворяясь в воде, электролиты распадаются или диссоциируют на «+»-но и «-»-но заряженные ионы (катионы и анионы). Примеры: катионы – ионы водорода и металлов; анионы – ионы кислотных остатков и гидроксогруппы. Процесс электролитической диссоциации можно показать при помощи химических уравнений: НCl=H++Cl-. Отклонение от законов Вант-Гоффа и Рауля объяснимо распадом электролитов на ионы.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. Ей противостояла химическая, или гидратная теория растворов Д.И. Менделеева, которая базировалась на представлении о взаимодействии растворенного вещества с растворителем. Преодолеть это, на первый взгляд, противоречие двух теорий позволило предположение о гидратации ионов, впервые сделанное И.А. Каблуковым в работе «Современные теории растворов в связи с учением о химическом равновесии». Это позволило в дальнейшем объединить две указанные теории в единую.
Пусть концентрация электролита, распадающегося на 2 иона, равна С, а степень его диссоциации в данном растворе составляет a, тогда уравнение для константы диссоциации примет вид:
Кдис=  , где сa - концентрация каждого из ионов, а с(1-a) – концентрация недиссоциированных молекул.
, где сa - концентрация каждого из ионов, а с(1-a) – концентрация недиссоциированных молекул.
Это уравнение представляет собой закон разбавления Оствальда. Оно позволяет определять степень диссоциации при разных концентрациях электролита, если определена его константа диссоциации; также константу диссоциации электролита, если известна его степень диссоциации при какой-либо концентрации.
Для растворов, в которых диссоциация электролита очень мала, уравнение закона Оствальда можно упростить. В данном случае a<<1, и, следовательно, этой величиной можно пренебречь в знаменателе правой части уравнения. Тогда это уравнение примет следующий вид:
Кдис@a2·с или a= 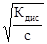 .
.
Таким образом, степень диссоциации возрастает при разбавлении раствора.
Величина Кдис электролита зависит от природы электролита и растворителя, температуры, но не зависит от концентрации раствора. Она характеризует способность электролита распадаться на ионы. Чем меньше Кдис электролита, тем слабее электролит. Значения Кдис различных электролитов приводятся в справочниках при Т=298К.
| Электролит | Константа диссоциации Кдис (при 25°С) |
| HNO2 | 4·10-4 |
| H2O2 | К1=10-12 к2=10-25 |
| H2SiO3 | К1=10-10 к2=10-22 |
| H2SO3 | К1=2·10-2 к2=10-14 |
| H2S | К1=6·10-8 к2=10-14 |
| CH3COOH | 1,74·10-5 |
| HCOOH | 1,8·10-4 |
| H2CO3 | К1=4,5·10-7 к2=4,7·10-11 |
| NH4OH | 1,8·10-5 |
| HF | 7·10-4 |
Самым слабым электролитом из приведенных является H2O2, а самым сильным – НСООН.
Вант-Гофф установил, что изотонический коэффициент i выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам. Последнее свидетельствует о неполноте диссоциации электролитов на ионы, т.к. в противном случае осмотическое давление (и пропорциональные ему величины) всегда было бы в целое число раз больше значений, наблюдаемых в растворах неэлектролитов. Аррениус объяснил это тем, что только часть электролита диссоциирует на ионы и ввел понятие степени диссоциации a (отношение числа молекул nдис, распавшихся на ионы, к общему числу молекул nS в растворе):
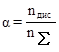 .
.
Позже было установлено, что все электролиты можно разделить на две группы: слабые и сильные. Сильные электролиты в водных растворах диссоциированны практически полностью. Понятие степени диссоциации к ним практически не применимо, а отклонение изотонического коэффициента от целочисленных значений объяснимо несколько иными причинами. Слабые электролиты диссоциируют в водных растворах лишь частично, и в растворе имеет место динамическое равновесие между недиссоциированными молекулами и ионами.
Для оценки состояния ионов в растворе вводят понятие активности – эффективной, условной концентрации иона, в соответствии с которой он действует при химических реакциях. Активность иона а равна его концентрации с, домноженной на коэффициент активности f: a=f·с. Коэффициенты активности различных ионов различны. Они изменяются при изменении условий, например, при изменении концентрации раствора.
Если f<1, то есть взаимодействие между ионами, приводящее к их взаимному связыванию.
Если f»1, то взаимодействие между ионами носит слабый характер.
В разбавленных растворах природа ионов мало влияет на значения коэффициентов активности. Приближенно считают, что коэффициент активности данного иона зависит только от его заряда и от ионной силы раствора I, которая является полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда:
I=0,5· 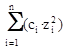 .
.
Дата добавления: 2014-12-26; просмотров: 1169;
