Окисление, восстановление и раскрытие кольца пиридина
Одно направление окисления пиридина – надкислотами – уже рассматривалось
Проявляя свой ароматический характер, пиридин достаточно устойчив к действию окислителей. Однако с ужесточением условий окисления окислители разрушают пиридиновое кольцо.
Представляет интерес сравнительная устойчивость к действию окислителей пиридина и бензола. В свое время, используя своего рода метод конкурирующих реакций, Чичибабин установил, что в одних условиях легче окисляется пиридиновое кольцо, в других – бензольное.
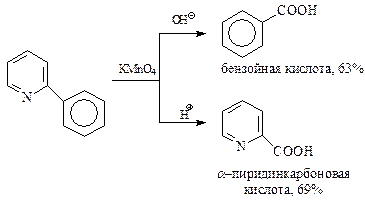
Как и в ароматическом ряду, боковые цепи пиридина окисляются значительно легче, чем кольцо. На этом основано получение практически важных карбоновых кислот пиридинового ряда. Особенное значение имеет окисление азотной кислотой метильной группы в β-пиколине
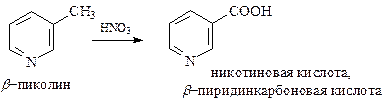
Никотиновая кислота и ее амид являются витамином РР, недостаток которого в организме (0,03-0,05 мг) вызывает заболевание – пеллагру. Это заболевание проявляется в сухости кожи, изъязвлении языка и поражении центральной нервной системы. Витамин РР содержится в печени, в дрожжах, в молоке и зародышах пшеницы.
Находят применение и производные никотиновой кислоты. Так. N,N-диэтиламид никотиновой кислоты под названием кордиамин,используется в качестве стимулятора центральной нервной системы
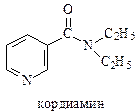
Пиридин восстанавливается легче, чем бензол. Восстановление можно осуществить атомарным водородом или каталитически до пиперидина
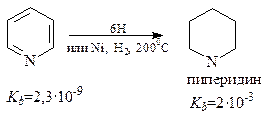
Пиперидин обладает свойствами обычного вторичного амина.
Пиперидиновое кольцо входит в молекулу многих биологически активных веществ и лекарств. В качестве примера приведем синтез обезболивающего вещества промедола, синтезированного Назаровым
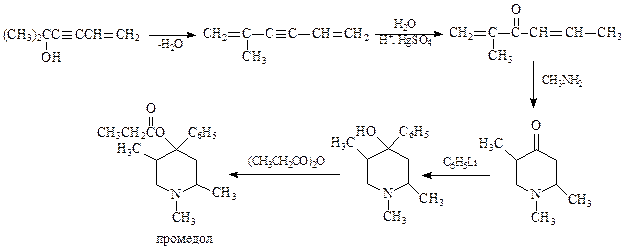
В отличие от бензола, пиридин довольно легко раскрывает свое кольцо. Вот несколько примеров реакций, протекающих с раскрытием кольца.
При восстанавлении иодистоводородной кислотой пиридин дает н-пентан
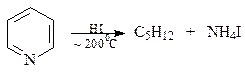
При каталитическом гидрировании пиридин превращается в амиламин
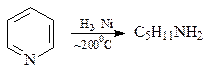
Предметный указатель
Абсолютная конфигурация
Адамантан
Адипиновая кислота
Адреналин
Азиды
Азобензол
Азокомпоненты
Азоксибензол
Азосоединения
Азосочетание
Азотистая кислота
Акриловая кислота
Акриловый альдегид
Акрилонитрил
Акролеин
Аланин
Ализарин
Алифатические соединения
Алкадиены
Алкалоиды
Алкансульфонаты
Алканы
Алкены
Алкилбензолсульфонаты
Алкилирование
-алкинов
-амидов
-аминов
-аренов
-дианионов β–дикарбонильных соединений
-карбоновых кислот
-малонового эфира
С-алкилирование
-ароматических аминов
-фенолов
О-алкилирование
-спиртов
-фенолов
Алкилсульфаты
Алкины
Алкоголиз
Аллены
Аллил-анион
Альдегиды см. Карбонильные соединения
Альдозы
Альдоли
Альдольная конденсация
Амиды
Амилазы
Амилоза
Аминирование
Аминокислоты
-D-ряда
-заменимые
-незаменимые
-С- и N-концевые
4-Аминомасляная кислота (ГАМК)
Амины
Аммиак
Аммонолиз
Амфетамин
Амфотерность
Анабизин
Анальгин
Ангидриды карбоновых кислот
Анестизин
Анетол
Анизол
Анилин
Аномеры
Антибиотики
Антрахинон-9,10
Антрацен
Арабиноза
Арены см. Бензол
Арилгалогениды
Арил-радикал
Ароматичность
Асимметрический атом
Аскорбиновая кислота
Аспарагин
Аспирин см. Ацетилсалициловая кислота
Атомная орбиталь
Атропин
Ацетальдегид
Ацетатный шелк
Ацетил
Ацетилацетон
Ацетилен
Ацетилнитрат
Ацетон
Ацетондикарбоновая кислота
Ацетонитрил
Ацетоуксусный эфир
Ацидофобность
Ацилирование
Ацил-катион
Байера-Виллигера реакция
Бакелиты см. Фенолформальдегидные смолы
Барбитураты
Белки
Бензальдегид
Бензамид
Бензиламин
Бензиловые эфиры
Бензо[а]пирен
Бензоил
Бензоилхлорид
Бензойная кислота
Бензол
Бензофенон
Бензофуран
Бишлера-Напиральского синтез
Борогидрид натрия
Бромирование см. Галогенирование
Бромомалоновый эфир
Бромоформ
Бутадиен-1,3
Бутаналь см. Масляный альдегид
Бутандиолы
Бутен-2-аль см. Кротоновый альдегид
Бутин
Вагнера реакция
Вагнера-Меервейна перегруппировка
Валериановая кислота
Валериановый альдегид
Валидол
Вальденовское обращение
Ван-дер-вальсов радиус
Веронал см. Барбитал
Вильсмайера-Хаака реакция
Вильямсона синтез
Винилацетат
N-Винилпирролидон
Винные кислоты
Виттига реакция
Витамин РР см. Никотинамид
Водородные связи
Вольфа реакция
Восстанавливающие дисахариды
Восстановление
-азосоединений
-амидов
-антрацена
-бензола
-галогенангидридов
-дисульфидов
-карбонильных соединений
Вулканизация каучуков
Высшие жирные кислоты
Высшие спирты
Вюрца реакция
Вюрца-Фиттига реакция
Габриэля синтез
Галактоза
Галловая кислота
Галогенирование
-алканов
-алкенов
-алкинов
-амидов
-аренов
-карбонильных соединений
-карбоновых кислот
-простых эфиров
-фенолов
Галоформная реакция
Ганча-Видмана система
Гаттермана-Коха реакция
Гваякол
Гексозы
Геля-Фольгарда-Зелинского реакция
Гем
Героин
Гетероауксин
Гетероциклические соединения
Гибридизация орбиталей
Гидразин
Гидразоны
Гидрирование
Гидрогенолиз
Гидроксилирование
Гидролиз
-ангидридов кислот
-амидов
-ацеталей
-галогеноуглеродов
-иминов
-простых эфиров
-сложных эфиров
-эпоксидов
Гиперконъюгация
Гистидин
Гликозидная связь
Гликозидный гидроксил
Гликоли см. Диолы
Глиоксалевая кислота
Глиоксаль
Глицерин
Глицериновый альдегид
Глицин
Глюкаровая кислота
Глюкоза
Глюконовая кислота
Гормоны
Гофмана расщепление амидов
Гофмана реакция
Гриньяра реактивы
Губена-Гёша реакция
Гулоза
Гунда правило
Гуттаперча
Дегалогенирование
Дегидратация
-амидов
-глицерина
-диолов
-спиртов
Дегидрирование
Дегидробензол
Дейтерирование
Декалин
Джонса реактив
Диазокомпоненты
Диазометан
Диазония соли
Диазотирование
Диастереомеры
Дибензофуран
Диеновый синтез
Диенофилы
Диены см. Алкадиены
Дильса-Альдера реакция
Димедрол
1,4-Диоксан
N,N-Диметиланилин
Диолы
Диполярные ионы
Дисалицид
Диэтиловый эфир
Дурол
Дьюара «бензол»
Енолы
Зайцева правило
Заместители
-электроноакцепторные
-электронодонорные
-I и II рода
Замещение
-нуклеофильное
--бимолекулярное
--в ароматическом ряду
--мономолекулярное
-радикальное
-электрофильное
Защитные группы
Зинина реакция
Ибупрофен
Изовалериановая кислота
Изовалериановый альдегид
Изолейцин
Изомасляная кислота
Изомасляный альдегид
Изомеризация
Изомерия
Изонитрилы
Изопрен
Изотопный эффект
Имидазол
Инверсия
Ингибиторы
Индикаторы
Индуктивный эффект
Интермедиат
Иодоформ
Иониты (ионообменные смолы)
Иоцича реактив
Иприт
Ихтиол
Камфен
Камфора
Канниццаро реакция
Капрон
Карбанионы
Карбены
Карбокатионы
Карбонаты
Карбонильные компоненты
Карбонильные соединения
Карбоновые кислоты
Карвон
Каучук
Каучук натуральный
Каучуки синтетические
Кетен
Кетоны см. Карбонильные соединения
Кижнера-Вольфа реакция
Кислотность
-алкинов
-амидов
-карбоновых кислот
-константа
-неорганических кислот
-нитроалканов
-спиртов
-фенолов
Кислоты
-Бренстеда
-карбоновые
-Льюиса
-сульфоновые
Классификация
-органических реакций
-органических соединений
Кляйзена перегруппировка
Кнёвенагеля реакция
Кнорра синтез
Колли-Толленса реактив
Кольбе реакция
Кольбе-Шмидта реакция
Конго красный
Конденсация
-альдольная
-бензидиновая
-сложноэфирная
-перекрестная сложноэфирная
Коновалова реакция
Конформации
Конформеры
Коричная кислота
Коричный альдегид
Коричный альдегид
Красуского правило
Кребца цикл
Крезолы
Кротоновая кислота
Кротоновая конденсация
Кротоновый альдегид
Ксенобиотики
Ксилолы
Кубан
Кумол
Кумольный способ
Кучерова реакция
Лавсан
Ладенбурга «бензол»
Лактамы
Лактаты
Лактиды
Лактоза
Лактоны
Левулиновая кислота
Лейцин
Лидокаин
Лизергиновая кислота
Лизин
Лимонен
Лимонная кислота
Линдлара катализатор
Линолевая кислота
Линоленовая кислота
Липиды
Локант
Магнийорганические соединения
Малахитовый зеленый
Малеиновый ангидрид
Малоновая кислота
Малоновый эфир
Мальтоза
Манниха реакция
Манноза
Марковникова правило
Масла см. Триацилглицерины
Масляная кислота
Масляный альдегид
Мезителен
Мезовинная кислота
Мезомерия
Мезомерный эффект
Мейзенгеймера комплекс
Металлоорганические соединения
Метанол
Метиленовые компоненты
Метиловый красный
Метиловый оранжевый
Метилфениловый эфир см. Анизол
Метилфенолы см. Крезолы
Метионин
Метоксибензол см Анизол
Микомицин
Миндальная кислота
Молекулярные орбитали
Молочная кислота
Монохлорамин-Б
Монохлорамин-Т
Мочевина
Муравьиная кислота
Найлон
Нафталин
Небензоидные ароматические соединения
Неопентан
Несмеянова реакция
Нитробензол
Нитрование
Нитрозирование
Нитросоединения
Нитрующая смесь
Новокаин
Номенклатура ИЮПАК
Ноотропил см. Пирацетам
Нуклеофильность
Озонолиз
Окисление
-азосоединений
-алканов
-алкенов
-алкинов
-альдегидов
-аминов
-кетонов
-оксимов
-простых эфиров
-спиртов
-фенолов
Оксалан см. Тетрагидрофуран
Оксалат кальция
Оксалилхлорид
Оксикислоты
Оксимы
Оксираны см. 1,2-Эпоксиды
Оксокислоты
Олеиновая кислота
Оптическая активность
Оптические антиподы
Основания
-Бренстеда
-Льюиса
Основность
Отщепление см. Элиминирование
Парафины
Параформальдегид (параформ)
Пентаналь см. Валериановый альдегид
Пептиды
Переэтерификация
Перкина реакция
Пероксидный эффект
Петролейный эфир
Пивалиновая кислота
Пиколины
Пикриновая кислота
Пинаколин
Пинаколиновая конденсация
Пинакон
Пиран(ы)
Пиранозы
Пирацетам
Пиридин
Пиридиний-катион (соли)
Пировиноградная кислота
Пирогаллол
Пирокатехин
Пирослизевая кислота
Пиррол
Пирролидин
Поверхностно-активные вещества
Поливинилпирролидон
Поливинилхлорид
Поликарбонат
Поликонденсация
Полимеризация
Полиметилакрилат
Полипропилен
Полисахариды
Полистирол
Полихлорпропен
Полиэтилен
Полиэтиленгликоль
Полиэтилентерефталат
Полиэфиры
Полуацетали
Поляриметрия
Пролин
Пропилен
Простагландины
Простые эфиры
Протеины см. Белки
Раймера-Тимана реакция
Рацематы
Рацемизация
Региоселективность реакции
Резонансная теория
Резорцин
Ренея никель
Ретинол
Реформатского реакция
Рибоза
Салициловая кислота
Салициловый альдегид
Сахарин
Сахарные кислоты см. Альдаровые кислоты
Сахароза
Свет плоскополяризованный
Свободные радикалы
Семикарбазоны
Семикарбозиды
Сенгера реакция
«Серебряного зеркало» реакция
Серин
Сквален
Скраупа синтез
Слизевая кислота
Сольватация
Сополимеры
Сопряжение
Сорбиновая кислота
Сорбит см. Глюцит
α-Спираль
Спиросоединения
Спирты
Стеарат натрия
Стеариновая кислота
Стереоизомерия
Стереоизомеры
Стереоспецифичность
Стирол
Стрептоцид
Стрихнин
Сукцинимид
Сульфадимезин
Сульфаниламиды
Сульфаниловая кислота
Сульфацил-натрий
Сульфиды
Сульфирование
Сульфоксиды
Сульфоны
Сульфоокисление алканов
Сульфохлорирование
Тартраты
Таутомерия
Твистан
Терефталевая кислота
Тетрагидропиран
Тетрагидрофуран
Тетралин
Тефлон
Тиолы
Тиофан
Тиофен
Тиофен-2-карбоновая кислота
Тищенко реакция
Тозилаты
Толленса реактив
Толуидины
Толуол
п-Толулсульфонилхлорид
Торсионный угол
Триазены
Триптофан
Трифенилметан
Трифенилметановый краситель
Тропилий-катион
Тростниковый сахар
Углеводы см. Моносахариды, Олигосахариды, Полисахариды
Удельное оптическое вращение
Уксусная кислота
Уксусный ангидрид
Ульмана конденсация
Ульмана реакция
Уретаны
Уротропин
Фалиминт
Фелинга реактив
Фенетол
Фенибут
Фенилгидразин
Фенолформальдегидные смолы
Фенолфталеин
Фенолы
Фентон реакция
Феромоны
Ферроцен
Фишера метод
Фолиевая кислота
Формалин
Формальдегид
Формамид
Формулы
Фосген
Фриделя-Крафтса реакция
Фриса перегруппировка
Фталевая кислота
Фталевый альдегид
Фталевый ангидрид
Фталимид
Фуллерены
Фумаровая кислота
Фуразолидон
Фуран
Фуранозы
Фурацилин
Фурфураль
Фурфуриловый спирт
Фурфурол
Хеуорса метод
Хиноны
Хиральность
Хлорамин-Т
Хлорангидриды
Хлороформ
Холестерин
Холин
Хризантемовая кислота
Хромофоры
Цвиттер-ион
Цефалоспорин
Циановодородная кислота
Цибетон
Циглера-Натта катализатор
Циклоалканы
Циклопентадиен
п-Цимол
Цистеин
Цитраты
Чичибабина реакция
Шимана реакция
Шиффа основания
Шоттена-Баумана реакция
Щавелевая кислота
Щелочное плавление
Эйкозан
Электроотрицательность
Электрофильное замещение
Элиминирование
Энантиомеры
Энергия активации
Энергия резонансная
Энергия сопряжения
Энтальпия
Эпимеры
1,2-Эпоксиды
Эстрадиол
Этанол
Этерификация
Этиламин
Этилацетат
Этилен
Этиленгликоль
Этилендиамин
Эфедрин
Эфирные масла
Эффект поля
Юрьева реакция
Яблочная кислота
Янтарная кислота
Янтарный альдегид
Авторский указатель
Альдер К.
Байер А.
Браун Ю.
Брёнстед Й. Н.
Бишлер А.
Вагнер Е.Е.
Валлах О.
Виллигер В.
Вильсмайер А.
Вильштеттер Р.М.
Вильямсон А.
Вольф Л.
Ганч А.
Гофман А.
Гриньяр В.
Дильс О.П.Г.
Дьюар М.
Канниццаро С.
Кижнер Н.М.
Кнорр Л.
Кнорр Э.
Кори Р.
Крафтс Дж. М.
Ладенбург А.
Лоури Т.М.
Манних К.
Марковников В.В.
Меервейн Г.Л.
Михаэль А.
Наметкин С. С.
Паули А.В.
Поллинг Л.К.
Ружичка Л.
Реней М.
Сенгер Ф.
Скрауп З. Х.
Терентьев А. П.
Толленс Б.
Фентон
Фишер Э. Г.
Фридель Ш.
Хеуорс У.
Хюккель Э.
Циглер К.
Чичибабин А. Е.
Эйлер У.
Юрьев Ю. К.
Использованная литература
1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. Органическая химия. Книга 1, 2. М: Москва.; 2008.
2. Галочкин А.И., Иванова И.В. Органическая химия. М: Дрофа., 2010. 399 с.
3. Степаненко Б.Н. Курс органической химии. М: Высшая школа. 1972. 600 с.
4. Неницеску К.Д. Органическая химия. Т. 1, 2. М. Иностранная литература. 1962.
5. Крам Д., Хэммонд Дж. Органическая химия. 1964. М: Мир. 714 с.
6. Кери Ф., Сандберг Р. Углубленный курс органической химии. Книга 1, 2. М: Химия. 1981.
7. Общая органическая химия. Под общей редакцией Бартока Д. и Оллиса У.Д. т. 12. 1981.
8. Робертс Дж., Касерио М. Основы органической химии. 1988.
9. Моррисон Р., Бойд Р. Органическая химия. М.: Мир, 1974. 1092 с.
10. Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. Т. 1-4. М.: Бином. Лаборатория знаний, 2007.
11. Марч Дж. Органическая химия. М. Мир, 1988, Т.1-4.
12. Смит В.А., Бочков А.Ф., Кейпп Р. Органический синтез. Наука и искусство. М.: Мир, 2001.
13. Нейланд О.Я. Органическая химия. М.: Высшая школа, 1990. 751 с.
14. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. СПб.: Иван Федоров, 2002. 624 с.
15. Травень В.Ф. Органическая химия. М.: Академкнига, 2003. Т. I, II.
16. Терней А. Современная органическая химия. М.: Мир, 1981. Т. I, II.
17. Несмеянов A. Н., Несмеянов Н. А. Начала органической химии. М. Химия. 1969. Т. I, II.
18. Streitwieser A., Heathcock C.H., Kosower E. Introduction to organic chemistry. Macmillan Publishing Company. N. Y. 4-th Ed. 1992. 1256 p.
19. Vollhardt K. P.C. Organic chemistry. W. H. Freeman and Co. N. Y. 1987. 1275 p.
20. McMurry J. Organic chemistry. Brooks/Cole Publishing Company. Monterey; California. 1984. 1167 p.
21. Wade L. G. Organic chemistry. Prentice-Hall. Inc. Englewood Cliffs. New Jersey. 1987. 1377 p.
22. Graham Solomons T. W. Fundamentals of organic chemistry. John Wiley and Sons. N. Y. 1982. 827 p.
23. Fessenden R. J., Fessenden J. S. Organic chemistry. 4-th Ed. Brooks/Cole. California. 1990. 1137 p.
Оглавление
Предисловие..
Часть первая…
Ациклические соединения..
Глава 1. Общие положения органической химии………..
1.1. Проблемы органической химии………………………
1.2. Этапы развития органической химии…………
1.3. Классификация и номенклатура органических соединений…….
1.4. Особенности соединений углерода…………
1.5. Строение атома и природа химической связи……….
1.5.1. Строение атома ………..
1.5.2. Химическая связь…….
1.5.2.1.Ионная связь………..
1.5.2.2.Ковалентная связь……
1.5.2.3.Донорно-акцепторная связь……..
1.6. Атом углерода и образуемые им связи……
1.7. Взаимное влияние атомов в органических соединениях…….
1.7.1. Индуктивный эффект…………..
1.7.2. Мезомерны й эффект……………
1.8. Пространственное строение молекул органических соединений..
1.8.1. Тетраэдрический атом углерода……………
1.8.2. Энантиомерия…………………..
1.8.3. Конформации……………………………….
Глава 2. Углеводороды
2.1. Алканы………………………………………..
2.1.1. Номенклатура алканов……………………
2.1.2. Способы получения……………………….
2.1.3. Химические свойства…………………….
2.1.3.1. Галогенирование…………………
2.1.3.2. Нитрование……………………….
2.1.3.3. Сульфирование…………………..
2.1.3.4. Окисление………………………..
2.1.3.5. Термолиз…………………………
2.2. Алкены……………………………….
2.2.1. Строение, изомерия, номенклатура…………….
2.2.2. Способы получения……………….
2.2.3. Химические свойства……………..
2.2.3.1. Присоединение серной кислоты……….
2.2.3.2. Гидратация…………
2.2.3.3. Галогенирование……………….
2.2.3.4. Гидрогалогенирование…………
2.2.3.5. Гипогалогенирование…………..
2.2.3.6. Присоединение альдегидов…….
2.2.3.7. Присоединение алленов………..
2.2.3.8. Алкилирование…………………
2.2.3.9. Оксосинтез…………………..
2.2.3.10. Присоединение карбена……….
2.2.3.11. Гидробромирование……………
2.2.3.12. Присоединение ССl4 ……………
2.2.3.13. Радикальное замещение…………
2.2.3.14. Гидрирование……………………
2.2.3.15. Окисление………………………….
2.3. Алкадиены……………………………………………
2.3.1. Методы получения…………………………………..
2.3.2. Химические свойства…………………………
2.3.2.1. Электрофильное присоединение…………..
2.3.2.2. Полимеризация…………………………….
2.3.2.3. Реакция Дильса-Альдера………………….
2.4. Алкины…………………………………………..
2.4.1. Методы получения………………………….
2.4.2. Химические свойства……………………….
2.4.2.1. Гидрирование………………………………
2.4.2.2. Окисление…………………………………..
2.4.2.3. Изомеризация ………………………………
2.4.2.4. Полимеризация………………………………
2.4.2.5. Кислотность………………………………….
2.4.2.6. Галогенирование…………………………….
2.4.2.7. Гидрогалогенирование…………………
2.4.2.8. Гидратация………………………………
2.4.2.9. Присоединение карбоновых кислот………
2.4.2.10. Присоединение спиртов…………………
2.4.2.11. Присоединение карбонильных соединений…………….
2.4.2.12. Присоединение синильной кислоты…………………….
Глава 3. Галогенпроизводные углеводородов………………..
3.1. Моногалогенпроизводные алканов…………………………
3.1.1. Способы получения……………………………………..
3.1.2. Химические свойства……………………………………………
3.1.2.1. Нуклеофильное замещение SN2………………………..
3.1.2.2. Нуклеофильное замещение SN1………………………..
3.1.2.3. Сравнение SN1- и SN2-реакций………………………..
3.1.2.4. Элиминирование………………………………………
3.2. Ди- и полигалогенпроизводные алканов………………..
3.2.1. Изомерия и номенклатура…………………………………….
3.2.2. Способы получения………………………………………….
3.2.3. Химические свойства…………………………………………
3.2.4. Отдельные представители…………………………………….
3.3. Галогенпроизводные непредельных углеводородов……………
Глава 4. Спирты и простые эфиры……………………………………
4.1. Предельные одноатомные спирты…………………………….
4.1.1. Изомерия и номенклатура…………………………………….
4.1.2. Методы получения………………………….
4.1.2.1. Гидрирование альдегидов и кетонов…………………
4.1.2.2. Магний органический синтез………………………….
4.1.2.3. Восстановление карбоновых кислот и сложных эфиров…
4.1.2.4. Алюмоорганический синтез…………………………………
4.1.2.5. Гидроборирование – окисление алкенов………………
4.1.2.6. Другие методы………………………………………….
4.1.3. Химические свойства……………………………….
4.1.3.1. Дегидратация………………………
4.1.3.2. Кислотно-основные свойства……..
4.1.3.3. Замещение гидроксила на галоген………………
4.1.3.4. Образование сложных эфиров…………….
4.1.3.5. Окисление и дегидрирование спиртов………………
4.1.3.6. Взаимодействие с магнийгалогеналкилами……………
4.2. Многоатомные предельные спирты……
4.2.1. Двухатомные спирты…..
4.2.2. Трехатомные спирты….
4.3. Непредельные одноатомные спирты..
4.4. Простые эфиры..
4.4.1. Изомерия и номенклатура…
4.4.2. Способы получения…..
4.4.3. Химические свойства….
Глава 5. Альдегиды и кетоны………….
5.1. Предельные альдегиды и кетоны…………
5.1.1. Номенклатура…..
5.1.2. Способы получения….
5.1.3. Химические свойства..
5.1.3.1. Гидрирование…
5.1.3.2. Окисление….
5.1.3.3. Окисление-восстановление…..
5.1.3.4. Реакции нуклеофильного присоединения….
5.1.3.4.1. Присоединение синильной кислоты…
5.1.3.4.2. Присоединение бисульфита натрия…
5.1.3.4.3. Присоединение реактивов Гриньяра…
5.1.3.4.4. Реакции с аммиаком и его производными…
5.1.3.4.5. Присоединение алкенов…
5.1.3.4.6. Присоединение воды….
5.1.3.4.7. Присоединение спиртов….
5.1.3.5. Полимеризация альдегидов….
5.1.3.6. Обмен кислорода карбонильной группы…
5.1.3.7. Реакции с участием α-водородных атомов…
5.1.3.7.1. Галогенирование…
5.1.3.7.2. Альдольная конденсация…
5.1.3.8. Кето-енольная таутомерия….
5.2. Ненасыщенные альдегиды и кетоны….
5.3. Кетены….
5.4. Диальдегиды и дикетоны…
Глава 6. Карбоновые кислоты….
6.1. Предельные одноосновные кислоты..
6.1.1. Методы получения..
6.1.2. Физические свойства…
6.1.3. Химические свойства…
6.1.3.1. Кислотность…..
6.1.3.2. Галогенангидриды карбоновых кислот
6.1.3.2. Ангидриды карбоновых кислот…
6.1.3.3. Этерификация. Сложные эфиры…
6.1.3.4. Амиды карбоновых кислот….
6.1.3.5. Амиды карбоновых кислот…
6.1.3.6. Нитрилы карбоновых кислот…
6.1.3.7. Декарбоксилирование….
6.1.3.8. Галогенирование карбоновых кислот в α -положение…
6.2. Непредельные карбоновые кислоты….
6.3. Дикарбоновые кислоты…
6.4. Оксокислоты…….
6.5. Оксикислоты…..
Глава 7. Азотсодержащие органические соединения
7.1. Нитросоединения….
7.2. Амины…
Глава 8. Углеводы….
8.1. Моносахариды….
8.1.1. Восстановление…
8.1.2. Окисление…
8.1.3. Алкилирование….
8.1.4. Этерификация….
8.1.5. Образование озазолов….
8.1.6. Увеличение длины углеродной цепи альдоз….
8.1.7. Уменьшение длины углеродной цепи альдоз…
8.1.8. Превращение альдозы в ее эпимер….
8.2. Глюкоза…
8.2.1. Строение (+)-глюкозы по Фишеру…
8.2.2. Циклическая структура D-(+)-глюкозы..
8.2.3. Определение размера кольца (+)-глюкозы…
8.3. Другие моносахариды…
8.4. Дисахариды….
8.4.1. (+)-Мальтоза…
8.4.2. (+)-Целлобиоза..
8.4.3. (+)-Лактоза..
8.4.4. (+)-Сахароза..
8.5. Полисахариды…
8.5.1. Крахмал…
8.5.1.1. Структура амилозы….
8.5.1.2. Структура амилопектина…
8.5.2. Целлюлоза…
Глава 9. Аминокислоты и белки…
9.1. Аминокислоты….
9.1.1 Стереохимия аминокислот…
9.1.2. Кислотно-основные свойства…
9.1.3. Методы получения аминокислот…
9.1.4. Химические свойства аминокислот…
9.2. Пептиды…
9.3. Белки..
Часть вторая..
Циклические соединения..
Глава 10…
Алициклические соединения..
10.1. Малые циклы..
10.1.1. Способы получения..
10.1.2. Химические свойства…
10.1.3. Кислородсодержащие производные малых циклов..
10.2. Пяти-, шестичленные циклы….
10.2.1. Циклопентан и его производные…
10.2.2. Циклогексан и его производные…
10.2.3. Взаимопревращения циклов….
10.3. Полициклические алифатические соединения…
10.4. Спираны и конденсированные циклические системы..
10.5. Средние и макроциклы..
10.5.1. Производные циклогептана….
10.5.2. Производные циклооктана..
10.5.3. Макроциклы…
10.5.4. Каркасные алициклы..
10.5.5. Терпеноиды…
Ароматический ряд
Глава 11..
Арены…
11.1. Строение бензола…
11.2. Ароматичность….
11.3. Изомерия и номенклатура…
11.4. Способы получения..
11.5. Химические свойства..
Реакции замещения…
11.5.1. Галогенирование..
11.5.2. Нитрование…
11.5.3. Сульфирование…
11.5.4. Алкилирование и ацилирование…
Реакции присоединения..
11.5.5. Гидрирование…
11.5.6. Галогенирование..
11.5.7. Озонирование….
Реакции боковой цепи..
11.5.8. Окисление..
11.5.9. Реакции присоединения к алкенилбензолам..
11.5.10. Закономерности реакций электрофильного замещения..
11.5.10.1. Теория резонанса…
11.5.10.2. Механизм электрофильного замещения в ароматическом ряду….
11.5.10.2.1. Генерирование электрофильных частиц..
11.5.10.2.2. Общий механизм электрофильного замещения..
11.5.10.2.3. Влияние заместителей на скорость замещения…
11.5.10.2.4. Влияние заместителей на ориентацию…
11.5.10.2.5. Передача электронных эффектов при замещении…
Глава 12
Арилгалогениды
12.1. Методы получения..
12.2. Химические свойства..
12.3. Механизм замещения ароматически связанного галогена…
Глава 13
Сульфокислоты…
13.1. Методы получения…
13.2. Химические свойства…
13.2.1. Реакции бензольного кольца..
13.2.2. Реакции сульфогруппы..
13.2.2.1. Кислотность..
13.2.2.2. Образование сульфохлоридов..
13.2.2.3. Сложные эфиры…
13.2.2.4. Сульфамиды..
13.2.3. Замещение сульфогрупы
Ароматические соединения кислорода…
Глава 14
Фенолы
14.1. Одноатомные фенолы..
14.1.1. Методы получения..
14.1.1.1. Гидролиз галогенпроизводных Аренов..
14.1.1.2. Щелочной сплав солей сульфониловых кислот..
14.1.1.3. Замещение диазогруппы на гидроксил..
14.1.1.4. Кумольный метод..
14.1.1.5. Разные реакции…
14.1.2. Химические свойства..
Реакции по гидроксильной группе
14.1.2.1. Кислотность…
14.1.2.2. Образование простых эфиров..
14.1.2.3. Образование сложных эфиров..
14.1.2.4. Отщепление гидроксильной группы..
Реакции по бензольному кольцу
14.1.2.5. Галогенирование…
14.1.2.6. Нитрование..
14.1.2.7. Сульфирование..
14.1.2.8. Алкилирование..
14.1.2.9. Ацилирование..
14.1.2.10. Нитрозирование..
14.1.2.11. Азосочетания..
14.1.2.12. Реакция Кольбе-Шмидта..
14.1.2.13. Реакция Реймера-Тимана..
14.1.2.14. Фенол-формальдегидные смолы..
14.1.2.15. Гидрирование..
14.1.2.16. Окисление…
14.2. Многоатомные фенолы..
14.2.1. Методы получения..
14.2.2. Химические свойства..
14.3. Хиноны..
14.4. Ароматические спирты..
Глава 15
Ароматические альдегиды и кетоны..
15.1. Альдегиды..
15.1.1. Методы получения..
15.1.1.1. Превращения арилметанов …
15.1.1.2. Превращения хлорметильной группы в арилметилгалогенидах…..
15.1.1.3. Восстановление производных карбоновых кислот..
15.1.1.4. Прямое введение альдегидной группы..
15.1.2. Химические свойства…
15.1.2.1. Автоокисление..
15.1.2.2. Конденсации..
15.2. Кетоны..
15.2.1. Способы получения…
15.2.1.1. Ацилирование..
15.2.1.2. Перегруппировка Фриса
15.2.1.3. Присоединение магнийорганических соединений к нитрилам..
15.2.2. Химические свойства..
15.2.2.1. Оксимы кетонов, их стереоизомерия и бекмановская перегруппировка..
15.2.2.2. Реакции α-водородных атомов..
15.3. Карбоновые кислоты..
15.3.1. Методы получения..
15.3.1.1. Окисление ароматических соединений..
15.3.1.2. Гидролиз нитрилов..
15.3.1.3. Ацилирование по Фриделю-Крафтсу..
15.3.1.4. Функционализация ароматических соединений..
15.3.2. Химические свойства..
15.3.2.1. Кислотность..
15.3.2.2. Действие нагревания
15.3.2.3. Участие в реакциях поликонденсации
Ароматические азотсодержащие соединения
Глава 16
Нитросоединения
16.1. Получение нитросоединений нитрованием..
16.2. Химические свойства…
16.2.1. Восстановление…
16.2.2. Влияние нитрогруппы на реакционную способность на реакционную способность других функциональных групп….
16.2.3. Комплексообразование с ароматическими углеводородами..
Глава 17
Амины
17.1. Методы получения..
17.1.1. Восстановление нитросоединений..
17.1.2. Аминирование галогенпроизводных.
17.1.3. Расщепление по Гофману..
17.1.4. Алкилирование и арилирование аминов..
17.2. Химические свойства…
Реакции по аминогруппе
17.2.1. Основность..
17.2.2. Реакция с азотистой кислотой..
17.2.3. Окисление..
Реакции с участием бензольного кольца
17.2.4. Галогенирование..
17.2.5. Нитрование..
17.2.6. Сульфирование..
17.3. Соли диазония..
17.3.1. Методы получения..
17.3.2. Химические свойства..
Реакции с выделением азота
17.3.2.1. Замещение на галоген..
17.3.2.2. Замещение на циано- и нитрогрппы
17.3.2.3. Замещение на гидроксил..
17.3.2.4. Замещение на водород…
17.3.2.5. Особенности реакций замещения диазогруппы
Реакции без выделения азота
17.3.2.6. Реакции азосочетания..
17.3.2.7. Восстановление..
Глава 18
Полициклические ароматические соединения
18.1. Ароматические соединения с изолированными бензольными кольцами…
18.1.1. Группа дифенила…
18.1.2. Полифенилалканы..
18.2. Ароматические соединения с конденсированными бензольными кольцами….
18.2.1. Нафталин..
18.2.2. Антрацен и фенантрен..
Глава 19
Гетероциклические соединения
19.1. α-Окиси олефинов..
19.2. Гетероциклические ароматические соединения..
19.2.1. Фуран…
19.2.2. Пиррол..
19.2.3. Индол..
19.2.4. Тиофен..
19.2.5. Пиридин..
Дата добавления: 2014-12-24; просмотров: 7990;
