Биологически активные соединения на основе пиррола
Г.Фишер в 1935 г. нагревая альдегид пирролового ряда с муравьиной кислотой, получил, хотя и с выходом всего в 1%, соединение исключительной важности – порфин
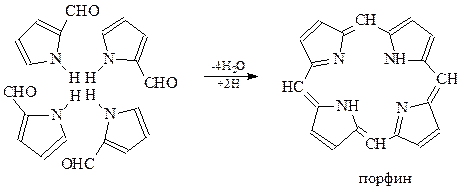
Муравьиная кислота в этой реакции выступает одновременно дегидратирующим и гидрирующим агентом.
Порфин удовлетворяет всем требованиям, предъявляемым к ароматическим системам. Молекула порфина плоская с системой чередующихся двойных связей. Число π-электронов в этой системе соответствует правилу Хюккеля при n=7 (4х7+2=30). В ароматическом сопряжении участвуют электроны 11 кратных связей между углеродными атомами (22 электрона) и 8 электронов четырех атомов азота. π–Электроны порфина делокализованы, молекула имеет симметричную структуру. Энергия резонанса пиррола составляет 104,67 кДж/моль. Двойные связи в вышеприведенной формуле порфина размещены произвольно. В действительности все пиррольные кольца эквивалентны, а положения водородных атомов при атомах азота – неопределенны.
Как ароматическое соединение порфин сульфируется олеумом, нитруется азотной кислотой, ацилируется по Фриделю-Крафтсу, образует комплексные соединения с металлами. В этих комплексах металл замещает два водорода азотов, а с остальными двумя азотами связан комплексно.
Самое главное предназначение порфина в том, что природа выбрала его для создания таких сложнейших соединений, без которых невозможно существование позвоночных животных и растений – гемоглобина (переносчик кислорода и углекислоты в организме) и хлорофилла, без которого невозможен процесс фотосинтеза.
Порфиновое кольцо, несущее заместители во всех или только в некоторых β-положениях пиррольных колец, входящих в порфиновую систему, называется порфирином. Порфирин с комплексно связанным двухвалентным железом называется гемином.В животных организмах гемин связан с глобином – белковой молекулой. Поэтому красящее вещество крови называется гемоглобином.
В хлорофиллах аи б порфирин несколько отличается от рассмотренногопорфирина, составляющего основу гемина. Кроме того, в качестве металла в хлорофиллах выступает магний. Ниже приводятся молекулы гемина и хлорофилла
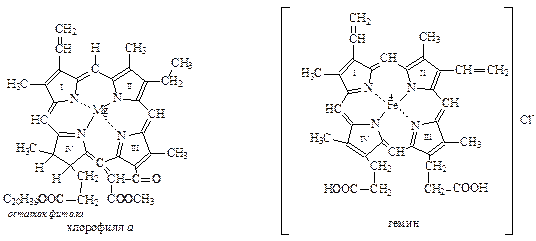
Небольшая историческая справка, чтобы молодое поколение химиков могло отдать должное своим предшественникам. Строение гемина было установлено Кюстером, Фишером и Вильштеттером (1929г.), а его полный синтез осуществлен в том же году Фишером. Строение хлорофилла а установлено благодаря исследованиям Вильштеттера, Конанта и Фишера. Полный синтез его осуществлен Вудвортом (1960 г.).
Система из четырех пиррольных колец так «приглянулась» природе, что она эту систему, немного видоизменив, использовала при создании витамина В12 (кобаламина). Суточная норма для человека этого витамина исчезающее мала – всего 3 мкг, однако его нехватка приводит к катастрофе для организма – злокачественной анемии. От этой болезни раньше, пока кобаламин не стал доступен, люди погибали. В России давно уже налажен микробиологический синтез В12.
В основу В12 положена т.н. корриновая система из четырех пиррольных колец, в которой атомы азота комплексно связаны с кобальтом и нитрильной группой.
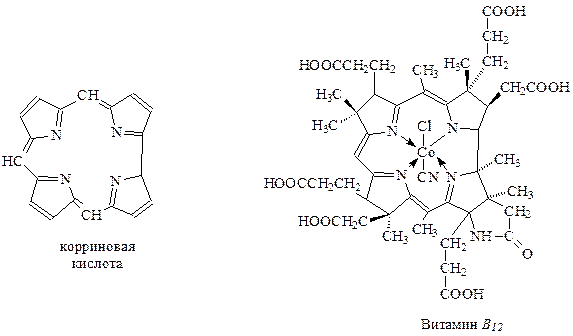
Индол
Среди многочисленных соединений, молекулы которых содержат пиррольное кольцо, имеются и такие, в которые это кольцо входит вместе с другими циклами, чаще всего с бензолом. В качестве примера таких соединений рассмотрим индол.
Индол имеет следующее строение
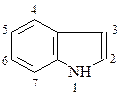
Способы получения. К индолу ведет внутримолекулярная конденсация формил-о-толуидина
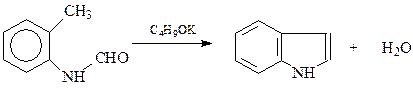
К такому же результату можно придти и внутримолеклярной конденсацией других о-замещенных анилинов
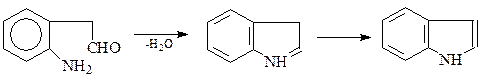
Общим методом получения замещенных индолов является реакция Фишера, заключающаяся в нагревании фенилгидразинов с ZnCl2 или серной кислотой
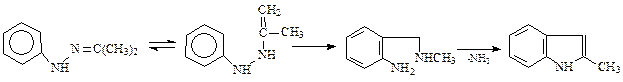
Химические свойства. По своим свойствам индол напоминает пиррол. В реакциях электрофильного замещения наиболее активными являются положения 2- и 3-пиррольного кольца. По причине ацидофобности индола эти реакции приходится проводить, избегая применения реагентов кислотного характера. Так, обычно индол хлорируют хлористым тионилом, нитруют этилнитратом, сульфируют комплексом Терентьева
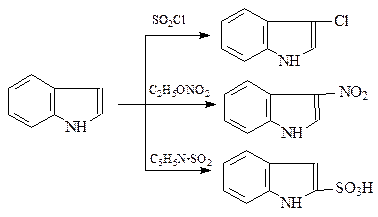
Среди производных индола большое значение имеет 3-индолилуксусная кислота (гетероауксин), являющийся стимулятором роста растений. Он получается реакцией иодистого N-индолилмагния c хлорацетонитрилом
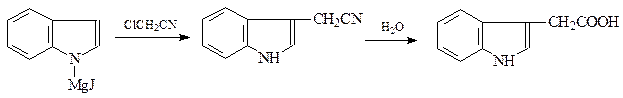
Другим известным производным индола является синий краситель индиго.Для его получения предложен следующий удобный метод
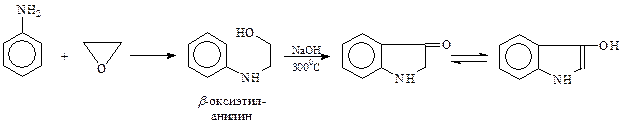
При окислении индоксила получается индиго
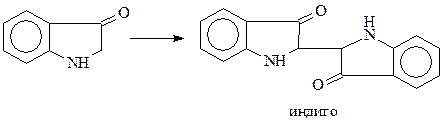
К производным индоксила относятся одна из незаменимых аминокислот – триптофани серотонин, который регулирует передачу нервных импульсов в нервных тканях
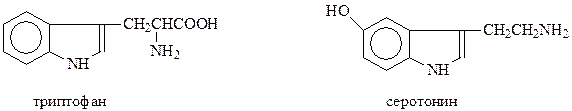
Тиофен
Представителем гетероциклических соединений, содержащих серу в качестве гетероатома, является тиофен

Тиофен был открыт в 1882 г. В.Мейером в бензоле, выделенном из каменноугольной смолы. Содержание тиофена в этом источнике составляет около 0,5%.
Строение. Тиофен, состоящий из четырех углеродов и атома серы, представляет собой плоский пятиугольник. Все атомы молекулы расположены в одной плоскости. Углеродные атомы тиофена находятся в sp2-гибридном состоянии. В пирроле не участвующие в гибридизации четыре электрона углеродов и два электрона атома серы образуют ароматический секстет. Длины связей в тиофене свидетельствуют о неравномерном распределении электронов в кольце
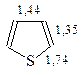
Энергия резонанса у тиофена больше, чем у фурана и пиррола и составляет 117,23 кДж/моль.
Способы получения.Для промышленного получения тиофена используется высокотемпературный процесс нагревания углеводородов с четырьмя атомами углерода – бутана или бутиленов – с серой при 700оС и при коротком времени контакта
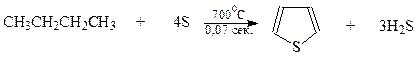
Подобно бензолу тиофен можно получить и исходя из ацетилена нагреванием алкина с сероводородом при 400-450оС
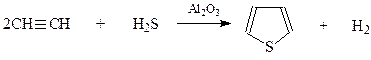
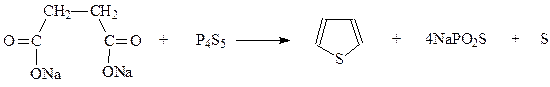
Для получения тиофена можно воспользоваться также одним из общих методов синтеза пятичленных гетероциклов с использованием 1,4-дикарбонильных соединений. При этом для введения атома серы в молекулу пользуются пятисернистым фосфором. Как и при получении фурана и пиррола 1,4-дикарбонильное соединение в реакции участвует в енольной форме
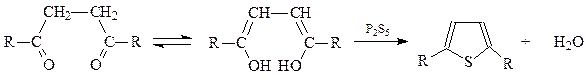
Наконец, из удобных лабораторных методов получения тиофена следует упомянуть метод, заключающийся в нагревании дикарбоновых кислот в виде их солей с пентасульфидом фосфора
Химические свойства.
Тиофен способен к превращениям по многим направлениям: электрофильному замещению, присоединению, обмену гетероатома, окисления и восстановления, раскрытия кольца.
Электрофильное замещение. Как π-избыточное соединение, тиофен в реакциях электрофильного замещения более активен, чем бензол. В конкретных реакциях реакционная активность превышает активность бензола в 103 – 106 раз. Благодаря этому в реакциях электрофильного замещения бензол можно использовать в качестве растворителя. В целом, тиофен занимает по реакционной способности положение между фураном и бензолом. Различные положения в тиофене значительно отличаются по π-электронной плотности
По этой причине реакции электрофильного замещения в тиофене идут более определенно, в основном, во второе положение.
Следует заметить, что тиофен, по сравнению с другими гетероциклами – пирролом и фураном, имеет более устойчивое кольцо к действию окислителей и высоких температур. К тому же он проявляет устойчивость к действию кислот, т.е. – менее ацидофобен. Особенностью тиофена является и то, что при проведении реакции электрофильного замещения с его участием не могут быть осуществлены реакции, предполагающие использование в качестве катализатора хлорида алюминия. Хлорид алюминия при контакте с тиофеном мгновенно осмоляется и дезактивируется.
Галогенирование. При взаимодействии с хлором тиофен образует смесь моно- и полихлорпроизводных, в том числе, продукты присоединения
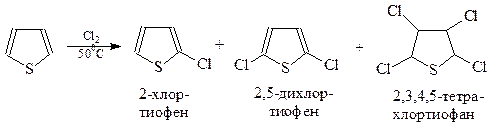
Поэтому приходится подбирать подходящий хлорирующий агент для получения преимущественно монохлорпроизводных. Хорошие результаты были получены при использовании хлористого сульфурила
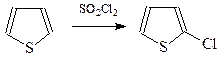
Тиофен можно успешно бромировать с получением 2-бром - и 2,5-дибромтиофенов и даже иодировать во второе положение кольца.
Галогенпроизводные тиофена через реактивы Гриньяра могут быть превращены в его функциональные производные: альдегиды и кетоны, карбоновые кислоты и др.
Сульфирование. Тиофен сульфируется концентрированной серной кислотой даже при комнатной температуре
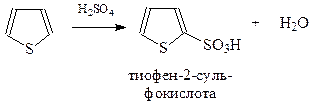
Эта реакция используется для очистки бензола от тиофена.
Для сульфирования могут быть использованы и другие сульфирующие агенты: хлорсульфоновая кислота и комплекс Терентьева.
Нитрование.Несмотря на устойчивость тиофена к действию кислот, устоять против окисляющего действия азотной кислоты он не может. Поэтому для получения нитротиофена приходится применять мягкодействующее нитрующее средство – ацетилнитрат. В этом случае в основном получается 2-нитротиофен с небольшой примесью 3-нитротиофена
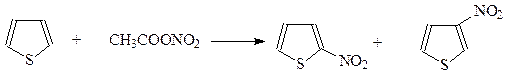
Интересно при этом, что дальнейшее нитрование 2-изомера приводит к смеси 2,4- и 2,5-динитротиофенов. Ввести три нитрогруппы в тиофеновое кольцо не удается.
Ацилирование.Тиофен ацилируется по Фриделю-Крафтсу во 2-положение кольца хлористым ацетилом в присутствии хлорного олова или трехфтористого бора
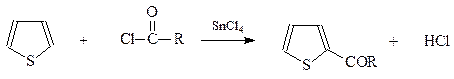
Хорошие результаты получены и в случае использования ангидридов карбоновых кислот. При этом в качестве катализатора обычно применяют фосфорную кислоту.
Алкилирование. К сожалению, из-за высокой активности карбокатионов в этой реакции, алкилирование тиофена протекает неоднозначно с образованием продуктов 2- и 3-замещения

При необходимости получения алкилтиофенов лучше исходить из более доступных ацилтиофенов, восстанавливая их, например, по Клемменсену.
В другие реакции электрофильного замещения тиофен не вступает.
Дата добавления: 2014-12-24; просмотров: 6073;
