Кислотно-основные свойства
Пиррол практически лишен основных свойств, т.к. электронная пара азота участвует в образовании ароматического секстета и не может принять протон. К тому же, если бы это случилось, пиррол лишился бы ароматичности и подвергся полимеризации и осмолению.
Освобожденная от участия в образовании ароматического секстета электронная пара азота сразу же сообщает соединению основность, которой обладают вторичные амины

А вот кислотность пиррола значительно превосходит его основность и находится на уровне кислотности фенола. Константа кислотности пиррола оценивается как 10-15, т.е. пиррол более сильная кислота, чем аммиак и алифатические амины примерно в 1018 раз.
Будучи кислотой, хотя и слабой, пиррол образует соли с щелочными металлами
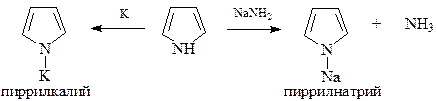
При алкилировании и ацилировании таких солей при температурах ниже ОоС образуются N-алкил- и N-ацилпирролы, которые при нагревании превращаются в 2-алкил- и 2-ацидпирролы. Покажем это на примере пиррилмагнийиодида

Известны и другие реакции этого типа.
Дата добавления: 2014-12-24; просмотров: 1875;
