Гетероциклические соединения
Гетероциклическими соединениями называются соединения, циклическая молекула которых включает в себя не только углеродные атомы, но и атомы других элементов. Очевидно, что гетероатом должен быть хотя бы двухвалентным. Чаще всего в качестве гетероатома выступает азот, кислород и сера. Молекула гетероциклического соединения может иметь в цикле несколько одинаковых или разных атомов. Исключительное многообразие и большое число гетероциклических соединений объясняется также и тем, что их молекула может состоять из колец различной величины и включать несколько колец.
В рамках общего курса органической химии обычно рассматриваются лишь такие гетероциклические классы, которые по строению и свойствам похожи на ароматические соединения. Это может создать ложное представление, что гетероциклические соединения бывают только ароматического характера. Это, конечно, не так. Полагают, что из общего числа органических соединений, известных на сегодня, более 70% принадлежат к гетероциклическим соединениям. Среди них встречаются соединения, действительно обладающие ароматическим характером, точно также, как и напоминающие по своим свойствам соединения алифатического ряда. Этим обусловлен выбор рассматриваемых классов гетероциклов в данной книге – они часто встречаются, имеют важные практические приложения и демонстрируют разнообразие свойств. Вместе с тем следует отметить, что изучение некоторых, произвольно выбранных, гетероциклов лишь в одной главе книги неизбежно будет носить поверхностный характер. Для более полного изучения гетероциклических соединений следует обращаться к монографической литературе.
11.1. α–Окиси олефинов
Для α-окисей характерно присутствие в их молекуле группировки из двух углеродных и одного кислородного атомов
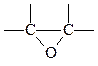
Соединения, содержащие α-окисное кольцо называют также эпокисями или оксиранами.
Эпокиси рассматривают обычно как циклические окиси алкенов
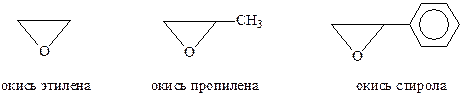
Для обозначения атома кислорода, связанного с углеродами, используется префикс эпокси
Методы получения. Окисление алкенов надкислотами с использованием целого ряда углеводородов было осуществлено Прилежаевым
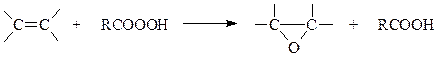
Чаще всего в качестве окислителя используется гидроперекись бензоила, хотя могут быть применены и другие надкислоты.
Легкость окисления по Прилежаеву зависит от числа и характера заместителей, находящихся у углеродов, связанных двойной связью. По этим признакам реакционная способность алкенов уменьшается в следующем ряду
R2С=СR2 › R2С=СНR › R2С=СН2 › RСН=СНR › RСН=СН2
У тетразамещенных алкенов скорость окисления настолько велика, что не удается измерить ее скорость.
Для промышленного получения простейших эпокисей более удобным оказалось каталитическое окисление алкенов кислородом воздуха. Наилучшим катализатором проявило себя серебро. Температура окисления лежит в пределах 400-450оС.
Наряду с получением α-окисей окислением, применяется и другой метод, заключающийся в дегидрохлорировании галогенгидринов под действием щелочи. Кстати, именно таким методом впервые была получена окись этилена Вюрцем в 1859 г.

Интересно отметить, что реакция дегидрохлорирования идет как внутримолекулярное нуклеофильное замещение, протекающее по SN2-механизму
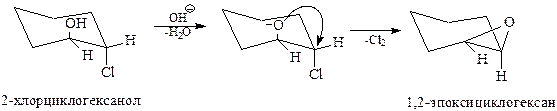
Химические свойства. Химические свойства эпоксидов определяются их строением. Эпокисное кольцо такое же напряженное, что и циклопропановое кольцо. В реакциях с электрофильными и нуклеофильными реагентами кольцо гетероцикла раскрывается и по месту освободившихся валентностей присоединяются элементы реагента.
Раскрытие кольца возможно в двух направлениях: либо по связи О-С1, либо по связи О-С2. В случае несимметричных α-окисей порядок раскрытия кольца зависит от условий проведения реакции. Так, в зависимости от использованного катализатора окись изобутилена дает первичные или третичные спирты
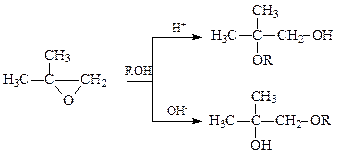
В случае кислого катализатора реакция идет через более стабильный карбокатион
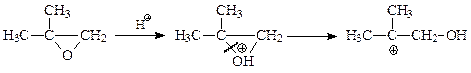
Щелочные катализаторы активируют реагент

Образующийся при этом алкокси-анион энергично атакует менее экранированный и более доступный углерод эпокиси
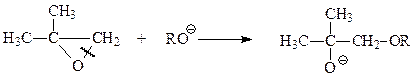
На примере реакции кислотного гидролиза эпоксидов можно видеть, что она идет как транс-присоединение
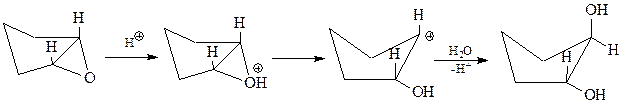
Рассмотрим конкретные реакции оксиранов, в которые они вступают и на использовании которых основано получение практически важных продуктов.
Гидролиз.При кислотно-катализируемом присоединении воды к оксирану образуются виц-диолы
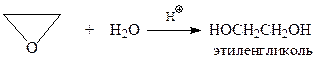
Один из них – этиленгликоль – широко применяется при получении антифризов - низкозамерзающих охлаждающих жидкостей для автомобильных двигателей. Кроме того, этиленгликоль при соконденсации с терефталевой кислотой дает ценный полимер полиэфирного типа – лавсан (терилен).
Присоединение кислот. В результате присоединения к эпокисям минеральных и карбоновых кислот в безводной среде образуются бифункциональные соединения
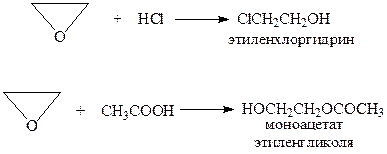
Присоединение спиртов и фенолов. Эпокиси, в частности окись этилена, легко присоединяют спирты. Поскольку продукты этой реакции – моно- и диэфиры этиленгликоля и диэтиленгликоля – широко применяются в качестве растворителей, рассмотрим их подробнее.
Взаимодействием окиси этилена и спиртов можно получить лишь моноэфиры. Для синтеза диэфиров приходится моноэфир алкилировать, например, с помощью диметилсульфата
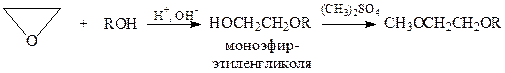
По указанной схеме получают:
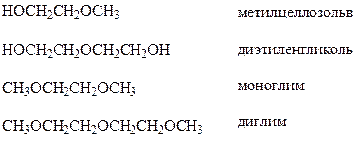
Окись этилена легко конденсируется с фенолом
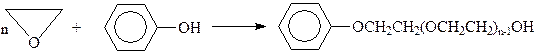
Такие эфиры, особенно содержащие в бензольном кольце алкильные радикалы, используются как поверхностно-активные вещества.
Присоединение аммиака и аминов. При присоединении к окиси этилена аммиака и аминов получаются аминоспирты – соединения, содержащие гидрокси- и аминогруппы
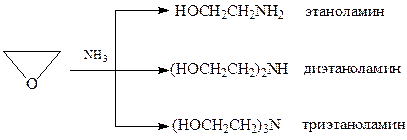
Присоединение аммиака и аминов к эпоксидам происходит таким образом, что аминогруппа связывается с более гидрогенизированным атомом углерода (правило Красусского)
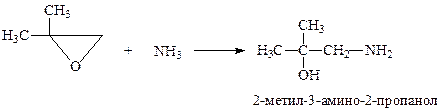
Этаноламины широко применяются для очистки газов от кислых компонентов (СО2, Н2S), с которыми они образуют легко генерируемые комплексы.
Изомеризация.Окись этилена термически (300-400оС) или термокаталитически (150-300оС) изомеризуется в ацетальдегид
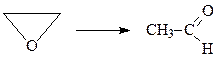
В качестве катализатора чаще всего используется оксид алюминия, фосфорная кислота и др.
Дата добавления: 2014-12-24; просмотров: 3384;
