Нафталин
Легкокристаллизирующийся нафталин (т.пл. 80оС) был выделен из каменноугольной смолы раньше бензола, еще в 1819 г. Гарденом.Содержание нафталина в этом источнике достигает 6% и он не потерял своего значения до наших дней. Состав нафталина был определен в 1838 г. Воскресенским, а строение установлено в 1866 г. Эрленмейером и Гребе.Приписываемое нафталину строение – два конденсированных бензольных кольца – подтверждено многочисленными синтезами и результатами физико-химических методов исследований. Однако метод доказательства, использованный Эрленмейером и Гребе, имеет познавательное значение. Поэтому он вполне заслуживает упоминания.
Эрленмейеру и Гребе было известно, что нафталин и α-нафтиламин при окислении образуют о-фталевый ангидрид, а α-нитронафталин – о-нитрофталевый ангидрид
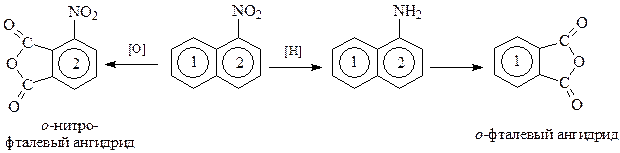
Этих данных оказалось вполне достаточно, чтобы убедиться, что оба кольца в нафталине бензольные, равноценные и связаны они в двух точках.
Строение нафталина.По современным представлениям нафталин представляет собой систему из двух бензольных колец, в которой все углероды sp2-гибридизованы и лежат в одной плоскости. В отличие от бензола, у которого все связи между углеродами имеют одинаковую длину, в нафталине он отличаются друг от друга
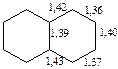
То, что в нафталине связи имеют различную длину и кольца не симметричны, свидетельствует о неравномерном характере распределения электронной плотности в молекуле.
Нафталин подчиняется правилу Хюккеля для ароматических систем - 4n + 2 при n=2 и содержит 10π-электронов.
Хотя нафталин и проявляет ароматический характер, однако он выражен в меньшей степени, чем у бензола. Как известно, бензол термодинамически более выгоден, чем гипотетический циклогексатриен на величину 150,73 кДж/моль. Можно было бы ожидать, что для нафталина, состоящего из двух бензольных колец, энергия резонанса составит величину 150,73 х2=301,46 кДж/моль. Однако резонансная энергия нафталина всего лишь 255,41 кДж/моль.
Таким образом, нафталин – ароматическая система, которая, однако, менее ароматична, чем бензол.
Не все свойства нафталина могут быть объяснены исходя из формул
Для объяснения некоторых реакций нафталина, в которые он вступает вопреки вышеприведенным формулам, изобразим его в виде резонансных структур
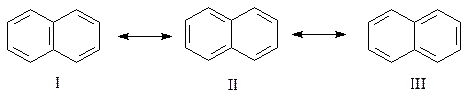
Из рассмотрения этих канонических формул видно, что в двух случаях из трех – II и III – на одно из колец приходится лишь две π-связи. Отсюда следует, что нафталин, с учетом вклада этих структур в резонансный гибрид, может рассматриваться как сочетание бензольного кольца с 1,3-диеновой системой. С учетом этого обстоятельства предлагалось молекулу нафталина изображать как систему, состоящую из бензола и диена
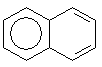
При таком подходе к строению нафталина становятся объяснимыми такие его свойства как склонность к вступлению в реакции 1,4-присоединения
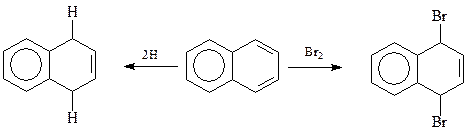
Удалось осуществить с нафталином за счет его 1,3-диеновой составляющей и такую классическую реакцию как реакция Дильса-Альдера. Правда, для этого пришлось использовать сильные диенофилы в жестких условиях (более 150оС)
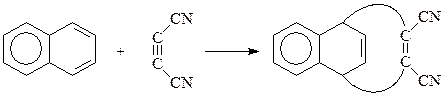
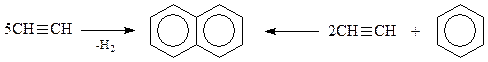
Способы получения. Нафталин образуется при пропускании ацетилена или же ацетилена и бензола над древесным углем при 400оС
Также как и в случае бензола, нафталиновые углеводороды могут быть получены реакцией дегидроциклизации исходя из подходящих алкилбензолов (Pt, 300оС)
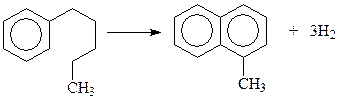
Для получения нафталина можно использовать и реакцию диенового синтеза с участием диенов и бензохинона в качестве диенофила
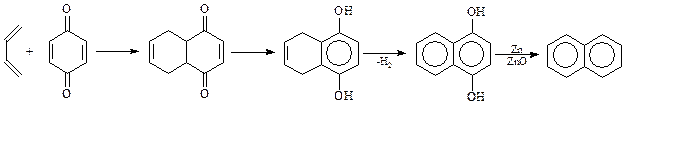
Наиболее универсальным синтезом нафталиновых соединений является, пожалуй, метод Хеуорса,представляющийсобой сочетание реакций ацилирования, восстановления оксо-групп по Клеменсену и ароматизацию тетралина дегидрированием
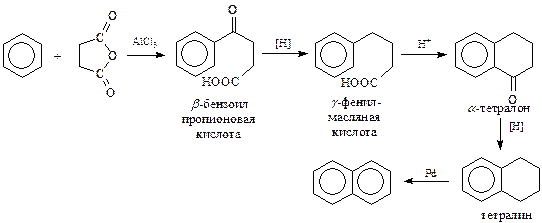
Синтез Хеуорса предоставляет широкие возможности для его модификации:
- при использовании замещенных бензолов заместитель в нафталине оказывается в β-положении;
- при помощи магнийорганического синтеза с участием оксо-групп β-бензоилпропионовой кислоты и тетралона в нафталиновое кольцо можно ввести одинаковые или различные заместители;
- при использовании замещенных янтарных ангидридов появляется возможность получения 2,3-дизамещенных нафталинов.
Химические свойства. Как уже отмечалось, нафталин – ароматическое соединение. Он вступает в реакции замещения, присоединения и восстановления – окисления.
В реакциях электрофильного замещения нафталин активнее бензола. Следует только отметить, что речь идет об одном из бензольных колец – первом. Для нарушения его ароматичности требуется лишь 104,68 кДж/моль, а оставшееся кольцо реагирует уже как обычное соединение моноароматического ряда. В этом случае для нарушения ароматичности требуется уже 150,73 кДж/моль.
В отличие от бензола, у нафталина два неравноценных положения α- и β. Поэтому электрофил в общем случае мог бы занять любое из них
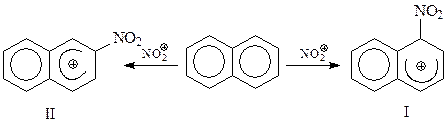
Однако оказалось, что в реакциях электрофильного замещения с участием нафталина более привлекательным является α-положение. Происходит это потому, что σ-комплекс с α-положением заместителя I оказывается более стабильным, чем другой возможный σ-комплекс II. Это хорошо видно, если эти комплексы изобразить, воспользовавшись теорией резонанса
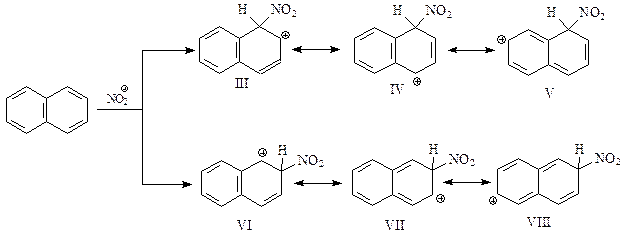
При α-замещении σ-комплекс, представляющий собой резонансный гибрид структур III, IV и V, включает в себя две неустойчивые канонические структуры с сохранением одного бензольного кольца – III и IV. В то же время σ-комплекс, образовавшийся при β-замещении включает лишь одну стабильную предельную структуру с сохранением бензольного кольца - VI. Это обстоятельство и обуславливает большую устойчивость I по сравнению с II. Считают, что I энергетически на 41,87 кДж/моль более выгодна, чем II.
Рассмотрим теперь конкретные реакции электрофильного замещения в нафталиновом ряду.
Нитрование и галогенирование. Нафталин нитруется и галогенируется в α-положение. Реакции идут настолько легко, что, например, галогенирование протекает даже без участия катализатора
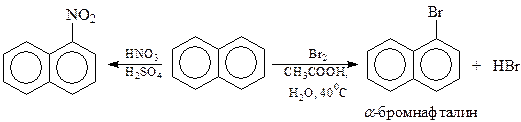
Через галоген- и нитро-производные открываются возможности для синтеза многих производных нафталина через амины и диазосоединения, а также через магнийорганические соединения.
Ацилирование. Нафталин под действием ацилирующих агентов в присутствии хлорида алюминия ацилируется. При этом место вступления остатка кислоты зависит от растворителя: в сероуглероде, тетрахлорэтане имеет место α-замещение, а в нитробензоле – в β-положение нафталиновой системы
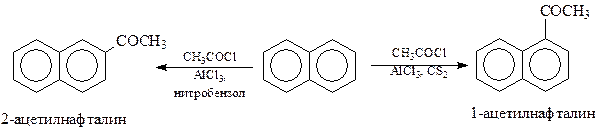
Предполагается, что нитробензол образует как с хлористым ацетилом, так и хлоридом алюминия, комплексы, для которых α-положение нафталина менее доступно по пространственным соображениям.
Сульфирование. Результаты сульфирования нафталина зависят от температуры, при которой проводится реакция. При повышенной температуре (160оС) основным продуктом реакции является β-нафталинсульфокислота, а при более низкой температуре - α-изомер
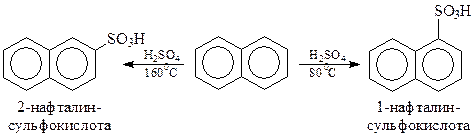
Интересно при этом, что при нагревании до 1600С α-изомер превращается в β-изомер.
Эти факты можно объяснить тем, что при более низких температурах сульфирования накопление продуктов реакции происходит в соответствии с относительными скоростями образования изомерных кислот. Уже отмечалось, что α-положение нафталина более подвержено электрофильной атаке, т.к. в этом случае реакция идет через более стабильный σ-комплекс (кинетический контроль). При повышенных температурах накопление продуктов идет в соответствии с термодинамическими устойчивостями изомеров – здесь преимущество за β-изомером нафталинсульфокислоты (термодинамический контроль).
В случае участия в реакциях электрофильного замещения производных нафталина, место вступления нового заместителя диктуется имеющимся заместителем.
При этом электронодонорные заместители способствуют реакции и новый заместитель направляют в α-положение того же кольца
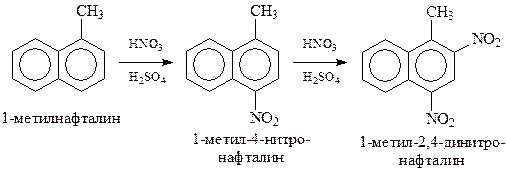
В то же кольцо вступает новый заместитель и в том случае, если в замещенном нафталине электронодонорный заместитель находится в β-положении
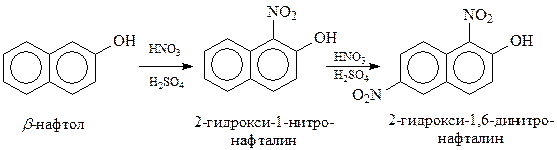
Электроноакцепторный заместитель в нафталине новый заместитель направляет в незамещенное кольцо в положения 5 и 8
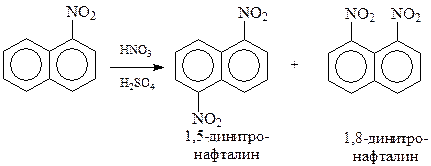
Электроноакцепторный заместитель в нафталине в β-положении затрудняет реакцию и новый заместитель направляет в незамещенное кольцо в положения 5 и 8
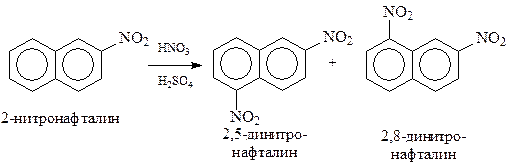
Кроме рассмотренных реакций, нафталин способен к окислению и восстановлению.
Восстанавливается нафталин легче, чем бензол, даже атомарным водородом. При этом в зависимости от температуры реакции, восстановление идет в положения 1 и 4 или 1, 2, 3 и 4
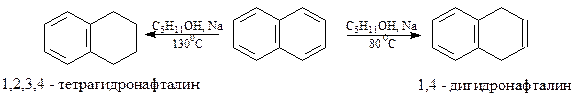
При каталитическом гидрировании нафталин вначале образует тетралин, который далее может, при более жестких условиях, превратиться в декалин
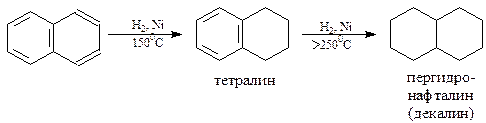
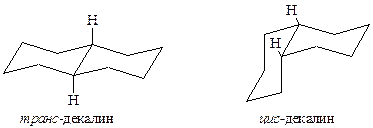
Интересно отметить, что декалин существует в виде цис- и транс-изомеров. В цис-изомере водороды у общих для двух циклогексановых колец углеродов расположены в цис-положении, а у транс-изомера – в транс-положении
В зависимости от условий проведения реакции, окисление нафталина приводит к различным кислоросодержащим продуктам. При окислении оксидом хрома в среде уксусной кислоты при комнатной температуре продуктом реакции оказывается нафтахинон, а окисление бихроматом калия направляется на боковую алкильную цепь
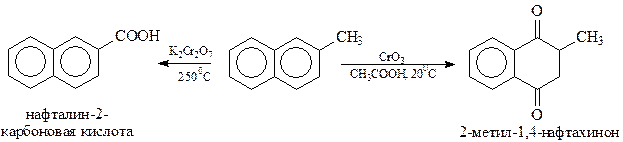
Нафталин окисляется легче, чем бензол. Это позволяет окислить одно бензольное кольцо нафталина, сохранив другое
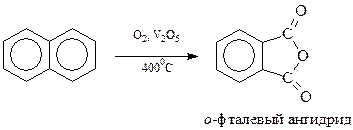
На этом основано получение о-фталевого ангидрида в промышленных масштабах.
Дата добавления: 2014-12-24; просмотров: 25767;
