Полифенилалканы
Дифенилметан. Простейшим углеводородом ряда полифенилалканов является дифенилметан. Для его получения обычно используется реакция Фриделя-Крафтса
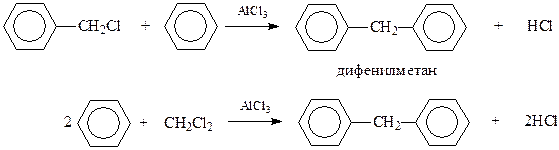
Другим удобным способом получения дифенилметана является восстановление бензофенона, например, амальгамированным цинком в соляной кислоте
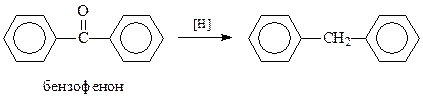
Еще один метод получения дифенилметана заключается в конденсации бензола с формальдегидом в присутствии серной кислоты
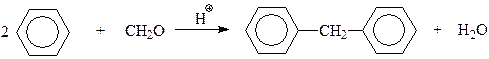
Использование в этой реакции гомологов бензола вместо бензола и других карбонильных соединений вместо формальдегида позволяет получать замещенные дифенилметаны.
Известное соединение, являющееся производным дифенилметана – кетон Михлера – получается при взаимодействии диметиланилина с фосгеном
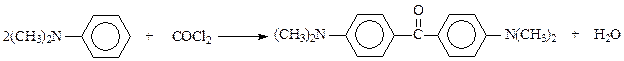
Химические свойства. По своим химическим свойствам дифенилметан ведет себя как ароматический углеводород – бензилбензол и замещенный метан.
Как ароматический углеводород дифенилметан вступает во все реакции электрофильного замещения как бензол, содержащий электронодонорный заместитель. Например,
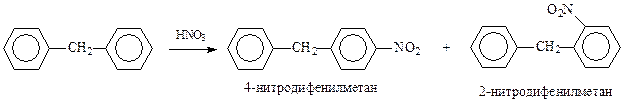
Как и следовало ожидать, при дальнейшем нитровании вторая нитрогруппа вступает в п- и о-положения второго кольца.
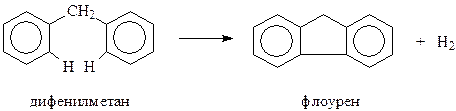
Дифенилметан, как и бензол, способен к термическому дегидрированию, который сопровождается внутримолекулярной конденсацией
В отличие от дифенила, в дифенилметане имеется еще один реакционный центр в виде метиленовой группы. Некоторые реакции дифенилметана идут с участием этой группы. Так, при действии окислителей из дифенилметана получается бензофенон, при галогенировании, например, с помощью пятихлористого фосфора – дифенилхлорметан
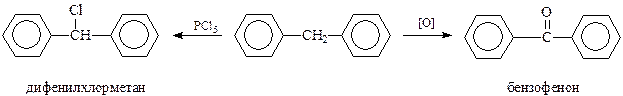
Трифенилметан. Соединения этого ряда не просто очередная группа органических соединений. Сам трифенилметан сыграл важную роль в утверждении теории радикальных реакций, поскольку трифенилметильный радикал оказался первым известным стабильным радикалом (Гомберг, 1900 г.). Работы Гомберга убедили химиков в существовании радикалов задолго до опытов Панета и появления физико-химических методов (ЭПР) их изучения. Кроме того, производные трифенилметана составляют основу трифенилметановых красителей.
Получение трифенилметана основано на использовании реакции Фриделя-Крафтса
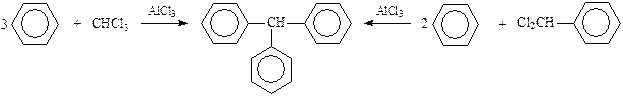
Трифенилкарбинол – производное трифенилметана, может быть получено реакцией бензофенона с фенилмагнийбромидом
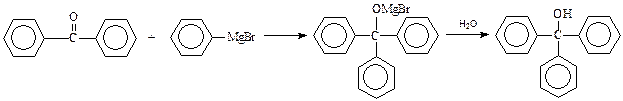
Синтез трифенилметановых производных может быть осуществлен конденсацией бензальдегида с фенолами и третичными ароматическими аминами
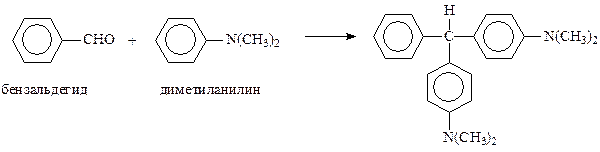
Химические свойства. В трифенилметане влияние трех бензольных колец на метиновый водород таково, что он становится более подвижным, кислым. Это находит свое отражение как в усилении кислотных свойств трифенилметана, так и в уменьшении энергии диссоциации между метиновым углеродом и водородом. У толуола энергия диссоциации (кДж/моль) составляет 355,48, а у трифенилметана – только 314,44. Кислотности соответственно (Ка) 10-35 и 10-33.
Благодаря ослаблению С-Н-связи и усилению кислотных свойств, трифенилметан удивительным образом способен как к гетеролитическому, так и гомолитическому разрыву этой связи с образованием трифенилметильных аниона, катиона и радикала. Вот некоторые примеры
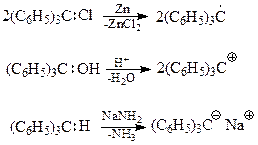
Наблюдаемый результат – это ослабление С-Н–связи в метиновой группе трифенилметана из-за влияния фенильных групп. Они могут влиять подобным образом, если только обладают электроноакцепторными свойствами. Интересно отметить, что в случае дифенила фенил, как уже об этом говорилось, выступает как донор электронов.
Хотя кислотность трифенилметана незначительна, однако он достаточно легко протонируется и под действием сильных оснований замещает свой протон на металл
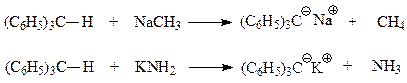
Трифенилметилнатрий можно получить также под действием амальгамы натрия на углеводород в эфирном растворе.
Установлено, что трифенилметилнатрий ионно построенное соединение, в эфирном растворе проявляющее электропроводность.
Существование в составе трифенилметилнатрия и калия аниона трифенилметила объясняется стабилизацией аниона в результате рассредоточения отрицательного заряда с участием трех бензольных колец. Для примера укажем делокализацию электронов лишь с участием одного бензольного ядра
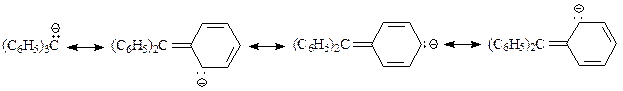
Понятно, что если бы в о- и п-положениях бензольного кольца находились электроноакцепторные заместители, то это привело бы к еще большей делокализации электронов и с участием уже и акцепторов электронов. Причем, этот путь стабилизации оказался бы более эффективным, чем стабилизация просто с участием бензольных колец.
В жидком SO2 трифенилметан электролитически диссоциирует с образованием трифенилметильного катиона, который, как и анион этого углеводорода, стабилизирован с участием трех бензольных колец
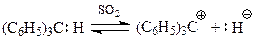
Делокализация положительного заряда в трифенилметил-катионе с участием бензольных колец происходит следующим образом (для примера покажем стабилизацию лишь с участием одного бензольного кольца)
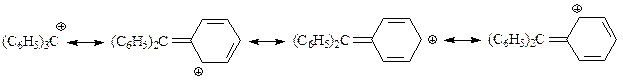
Электронодонорные заместители в о- и п-положениях трех бензольных колец еще более стабилизируют катион. Так, содержащий три диметиламиногруппы в указанных положениях (п-диметиламинофенил)-хлорметан образует в водном растворе устойчивый катион
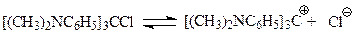
В этом катионе положительный заряд делокализован на трех атомах азота.
В 1900 г. Гомберг опубликовал результаты своих исследований по синтезу сполна фенилзамещенного этана с использованием реакции Вюрца
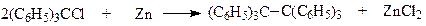
Однако, вместо гексафенилэтана, Гомберг получил какое-то вещество, которое при взаимодействии с кислородом воздуха или иодом с необыкновенной легкостью образовывал соответствующие производные. В своей публикации Гомберг отметил, что «экспериментальные данные, описанные выше, привели меня к выводу, что в данном случае мы имеем дело со свободным радикалом, трифенилметилом (С6Н5)3С »
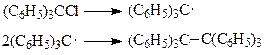
Гексаметилэтан, образовавшийся в результате рекомбинации двух трифенилметильных радикалов, находится в равновесии с гексафенилэтаном
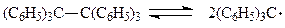
Этот радикал легко связывается даже при 0оС кислородом воздуха и иодом
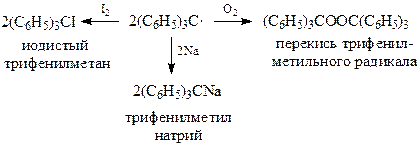
Смещение положения равновесия между углеводородом и радикалом в сторону трифенилметилового радикала объясняется двумя обстоятельствами.
С одной стороны, связь между этановыми углеродами в углеводороде, «раздираемая» шестью фенилами, значительно ослаблена. Эта связь имеет энергию диссоциации всего 46,06 кДж/моль и длину связи – 0,158 нм. Для сравнения в этане энергия связи составляет 347,52 кДж/моль, а длина связи 0,154 нм. При обсуждении рассматриваемого равновесия надо иметь в виду также стерическое препятствие сближению и установлению связи между радикалами.
С другой стороны, трифенилметильный радикал отличается значительной устойчивостью из-за возможности эффективной делокализации неспаренного электрона с участием трех бензольных колец
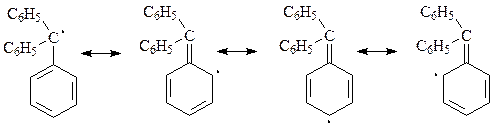
Ради точности необходимо отметить, что продукт рекомбинации двух трифенилметильных радикалов имеет строение не гексафенилэтана, а является 4-трифенилметил-1-дифенилметиленциклогексадиеном-2,5
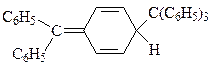
Впрочем, для опытов Гомберга, впервые приведших к стабильному радикалу, это значения не имело.
Трифенилметильные соединения широко используются в качестве красителей. Как пример можно привести фенолфталеин. Этот краситель используется также в качестве весьма распространенного индикатора
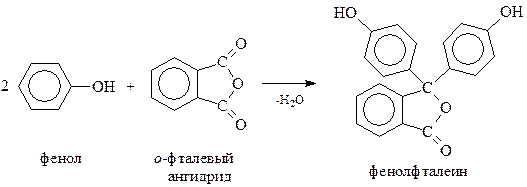
Получение другого общеизвестного красителя – малахитового зеленого – заключается в конденсации бензальдегида и диметиланилина с получением бесцветного лейкооснования, который при окислении дает карбинол. Спирт при обработке кислотой превращается в окрашенную соль
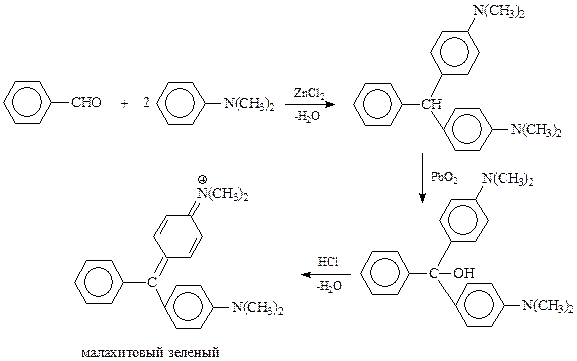
Дата добавления: 2014-12-24; просмотров: 7768;
