Группа дифенила
Способы получения.Имеется несколько удобных методов получения соединений ряда дифенила.
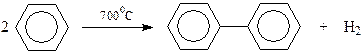
Для получения самого дифенила обычно используется термическое дегидрирование бензола, сопровождающееся конденсацией двух молекул этого углеводорода (Бертло, 1867 г.)
При получении дифенила можно исходить также из ароматических галогенпроизводных. Найдено, что для этого лучше всего подходят иодпроизводные. При их нагревании с медным порошком с высоким выходом образуются дифенилы, например,
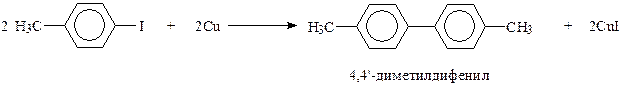
Этот синтез с участием иодпроизводных аренов и меди носит название реакции Ульмана (1903 г.). Видно, что рассматриваемая реакция, как и реакция Фиттига – это реакция Вюрца в приложении к ароматическому ряду.
Реакция Гомберга-Бахмана, заключающаяся во взаимодействии солей диазония с бензолом в щелочной среде, позволяет получать несимметричные замещенные дифенилы
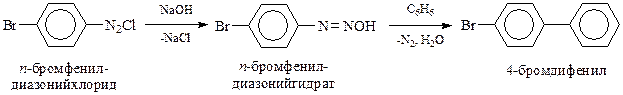
Для получения функциональных производных дифенила используются различные реакции. Так, n,п’-диаминодифенил (бензидин), широко используемый в производстве красителей, получают бензидиновой перегруппировкой (Зинин) гидразосоединений
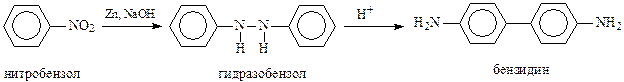
Получаемая из бензидина диазотированием соль диазония легко вступает в реакцию азосочетания с подходящим партнером с образованием соединений, которые относят к азокрасителям. Так, известный краситель – конго-красный – получают азосочетанием дифенилдиазониевой соли с нафтионовой кислотой

Химические свойства. До обсуждения химических свойств дифениловых соединений отметим, что бензольные кольца в этом соединении находятся в одной плоскости (копланарны). Хотя их заместители, даже водородные атомы, стремятся нарушить копланарность. Электроны бензольных колец взаимодействуют друг с другом, сопрягаются. Это приводит к существенному уменьшению длины σ-связи между бензольными ядрами. В дифениле эта связь имеет длину 0,148 нм, в то время как в этане связь между углеродами составляет 0,154 нм.
Соединения ряда дифенила по своим химическим свойствам повторяют свойства бензола и его производных. Они проявляют ярко выраженный ароматический характер и легко вступают в реакции электрофильного замещения. При этом одно бензольное кольцо ведет себя по отношению к другому как электронодонорный заместитель, т.е. как о-, п-ориентант. Однако о-ориентирование не может проявиться в полной мере из-за пространственных затруднений. Поэтому реакции хлорирования, нитрования и сульфирования идут как п-замещение. В этих реакциях новый электронодонорный заместитель вступает во второе кольцо также в п-положение, например,
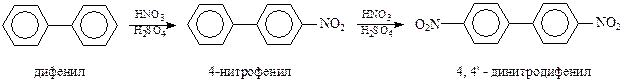
В случае дифенилов, уже содержащих в качестве заместителя заместитель первого рода, второй заместитель входит в то же ядро в положение 3
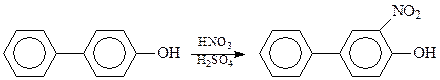
Поскольку дифенил – это фенилзамещенный бензол и фенил в данном случае выступает как электронодонорный заместитель, то дифенил в реакциях электрофильного замещения более реакционоспособен, чем бензол. По этой причине реакция ацетилирования дифенила может быть осуществлена в среде бензола как растворителя.
Дифенил обладает высокой устойчивостью к нагреванию и окислению. Как уже было упомянуто, даже при 700 – 800оС как раз образуется, а не разрушается.
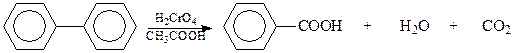
Хромовая кислота в среде уксусной кислоты с трудом окисляет дифенил в бензойную кислоту
В то же время, алкильные заместители в дифениле окисляются гораздо легче. Это позволяет, кроме получения соответствующих кислот дифенилового ряда, синтезировать и фенолы в результате процесса, напоминающего получение фенола и ацетона окислением изопропилбензола
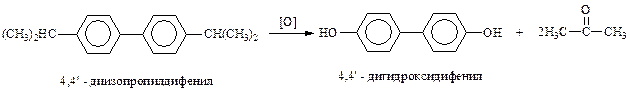
Благодаря высокой термической и химической устойчивости дифенила он широко используется в качестве высокотемпературного теплоносителя.
В технике находят применение и хлорированные дифенилы. Однако следует отметить, что некоторые из них чрезвычайно токсичны.
Самым высокотоксичным ксенобиотиком признан 2,3,7,8-тетрахлор-р-дибензодиоксин. Если его токсичность принять за единицу, то токсичности некоторых полихлорированных дифенилов имеют следующие значения
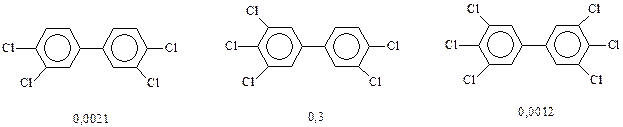
Дата добавления: 2014-12-24; просмотров: 10000;
