Методы получения. Для получения ароматических альдегидов могут быть использованы все ранее рассмотренные методы: окисление первичных спиртов
Для получения ароматических альдегидов могут быть использованы все ранее рассмотренные методы: окисление первичных спиртов, восстановление карбоновых кислот, гидролиз гем-дизамещенных галогенпроизводных, пиролиз смешанных солей карбоновых кислот и др. Вместе с тем ароматические альдегиды получают и с использованием специфических методов, которые пока еще не рассматривались. Обращает на себя внимание тот факт, что эти методы базируются на преобразованиях определенных функциональных групп уже находящихся в бензольном кольце.
15.1.1. Превращения арилметанов. В отличие от алифатического ряда, в ароматическом ряду возможна прямая трансформация метильной группы в альдегидную группу в арилметанах. Наиболее просто это достигается парофазным окислением метильной группы в аренах кислородом воздуха в присутствии окиси ванадия или жидкофазным окислением при 40оС двуокисью марганца в 65%-ной серной кислоте
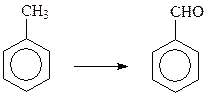
В обоих случаях реакция может идти дальше, поскольку альдегиды легко окисляются до карбоновых кислот. Для предотвращения этого стремятся связать альдегид по мере его образования.
Одним из таких способов является окисление метилпроизводных раствором хромового ангидрида в уксусном ангидриде. В этом случае альдегид по мере образования превращается в гем-диацетат, устойчивый к окислению. Кислотным гидролизом диацетата получают сам альдегид

Другим примером реакции подобного типа является реакция Этара. В этом случае окисление метильной группы осуществляется хлористым хромилом в сероуглероде при 25-45оС. При этом получается молекулярный комплекс, содержащий два эквивалента хлористого хромила. При разложении последнего водой получается альдегид, хромовая кислота и хлористый хром
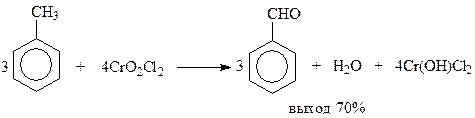
15.1.1.2. Превращения хлорметильной группы в арилметилгалогенидах.Одними из доступных органических соединений, из которых могут быть получены ароматические альдегиды, являются арилметилхлориды. Превращение хлорметильной группы в альдегидную группу может быть достигнуто несколькими способами. Кроме окислительного гидролиза это реакция Соммле.
В реакции Соммле арилметилгалогенид реагирует с уротропином (гексаметилентетрамином) с образованием четвертичной соли, которая через ряд стадий окисляется в альдегид
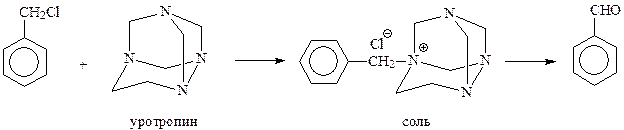
В реакцию Соммле не вступают арилметилгалогениды, в молекуле которых хлорметильная группа соседствует с другими заместителями.
15.1.1.3. Восстановление производных карбоновых кислот.Из производных карбоновых кислот для получения альдегидов чаще всего используются хлорангидриды. Восстановление в этом случае можно вести на никелевых или палладиевых катализаторах. Для предупреждения дальнейшего восстановления образовавшегося альдегида в спирт, катализатор несколько «отравляют» обработкой, например, серой в хинолине (метод Розенмунда)
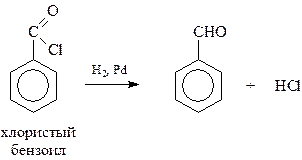
В случае некоторых пространственно затрудненных галогенангидридов необходимость в отравлении катализатора серой отпадает.
Кроме восстановления хлорангидридов кислот по Розенмунду, известны и другие методы восстановления. Считается, что одним из лучших из них является восстановление три-трет-бутоксиалюмогидридом лития при -78оС в растворе диглима
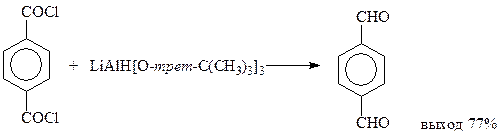
Низкая температура реакции препятствует дальнейшему восстановлению альдегида в спирт.
Следует отметить, что кроме восстановления известны и другие методы превращения галогенацилов в альдегиды (реакции Грундмана, Зона-Мюллера и др.).
Альдегиды могут быть получены и из нитрилов карбоновых кислот. В этом случае нитрил смешивают с безводным хлористым оловом и через смесь пропускают хлористый водород (реакция Стефена). При этом последовательно получается неустойчивый иминохлорид, альдиминовый комплекс и, при гидролизе последнего, альдегид
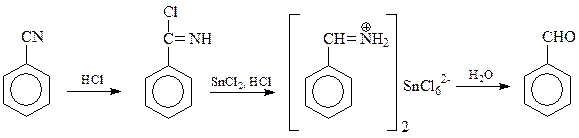
15.1.1.4. Прямое введение альдегидной группы. Введение альдегидной группы в ароматическое кольцо достигается в условиях реакций Гаттермана-Коха и Реймера-Тиммана. Обе эти реакции относятся к реакциям электрофильного замещения в ароматическом ряду и поэтому они протекают с соблюдением соответствующих закономерностей.
В реакции Гаттермана-Коха на ароматическое соединение (кроме самого бензола и соединений с электроноакцепторными заместителями) действуют смесью хлористого водорода и оксида углерода в присутствии хлористого алюминия и однохлористой меди
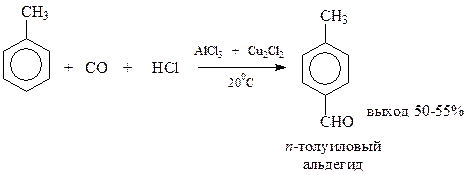
Предполагается, что вначале оксид углерода и хлористоводородная кислота образуют нестойкий хлористый формил, который дальше реагирует по реакции Фриделя-Крафтса
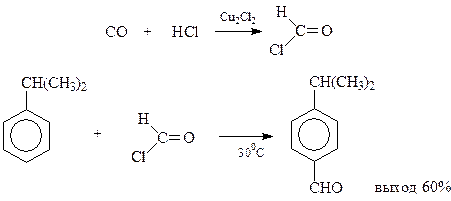
В случае ароматических соединений с электронодонорными заместителями вместо оксида углерода можно использовать синильную кислоту или ее соли (реакция Гаттермана), а в качестве катализатора – хлористый цинк
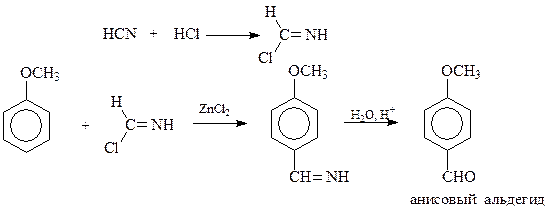
В реакции Реймера-Тимманана активное в реакции электрофильного замещения ароматическое соединение действуют хлороформом и щелочью
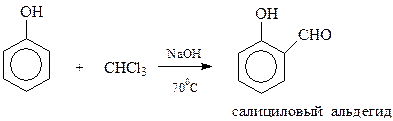
Имеются основания трактовать реакцию Реймера-Тимана как электрофильное замещение, т.к. при ее осуществлении появляется активный фенолят-ион

А электрофильная частица при этом возникает под действием щелочи из хлороформа
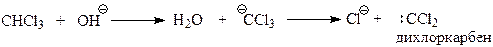
В дихлоркарбене углерод окружен лишь шестью электронами и поэтому он является сильным электрофилом.
В реакции Реймера-Тимана вначале образуется бензальхлорид, который в щелочной среде гидролизуется в альдегид
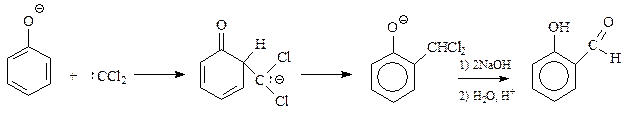
На участие в рассматриваемой реакции именно фенолят-иона указывает то обстоятельство, что соединения, которые не могут образовать этот ион (например, анизол), не участвуют в реакции Реймера-Тимана.
Дата добавления: 2014-12-24; просмотров: 3509;
