Химические свойства
Многоатомным фенолам присущи свойства, характерные и для одноатомных фенолов. В то же время почти у каждого из них встречаются свои особенности.
Кислотность. У двухатомных фенолов кислотные свойства выражены сильнее, поэтому они способны образовать соли не только с щелочными металлами
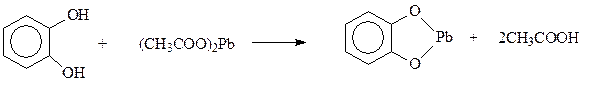
Реакции по бензольному кольцу. В реакции электрофильного замещения двухатомные фенолы вступают много легче, чем фенол. В кольцо двухатомных фенолов удается ввести два и даже три новых заместителя даже в мягких условиях. При электрофильном замещении с участием резорцина гидроксилы действуют согласованно
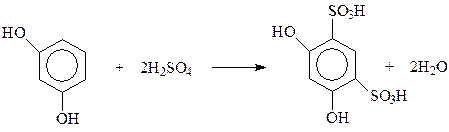
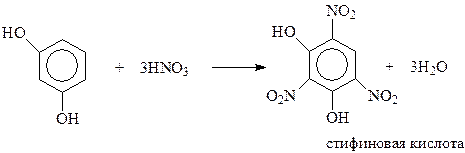
Окисление. Двухатомные фенолы с гидроксилами в о- и п-положениях легко окисляются и поэтому являются сильными восстановителями. Продуктами окисления пирокатехина и гидрохинона являются соответствующие хиноны
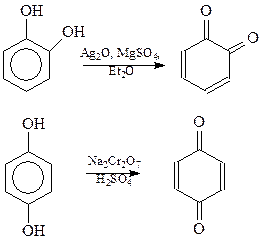
Резорцин также способен окисляться, однако по структурным соображениям не может образовать хинон.
Особенности многоатомных фенолов. Как уже отмечалось, почти каждый из многоатомных фенолов, участвуя в химических реакциях, проявляет особенности. Так, резорцин – единственный из фенолов, способный восстанавливаться водородом в момент выделения. Установлено, что восстанавливается при этом енольная форма резорцина
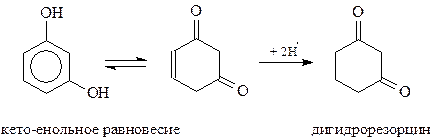
Точно также гидрохинон – единственный из фенолов, участвующий в реакции Дильса-Альдера как диен (Куксон, 1955 г.)
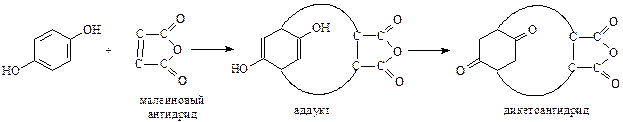
Не менее своеобразно окисляется шестиатомный фенол. При окислении кислородом воздуха он вначале превращается в тетраоксихинон. В дальнейшем хинон образует диоксихинон - родизоновую кислоту. Продуктом исчерпывающего окисления последней азотной кислотой является трихиноил (гексакетоциклогексан)
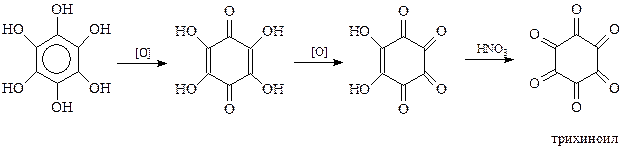
Хиноны
Хиноны относятся к сопряженным циклическим дикетонам. У них с фенолами тесные взаимоотношения: фенолы и хиноны легко превращаются друг в друга.
Простейший и наиболее распространенный хинон был получен Воскресенским (1838 г.) окислением хинной кислоты (1,3,4,5-тетраоксигексагидробензойная кислота) двуокисью марганца в серной кислоте
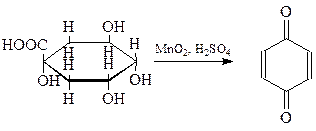
Свое название хинон получил от названия хинной кислоты.
Хиноны подразделяются на 1,2- и 1,4-хиноны или о- и п-хиноны. Как уже отмечалось, 1,3-хиноны не могут существовать по структурным соображениям. Интересно, хиноны различимы по цвету кристаллов: п-хиноны в большинстве случаев бывают желтыми, а о-хиноны – оранжевыми или красными.
Основные методы получения хинонов уже рассматривались – это окисление двухатомных фенолов и окисление анилина хромовой кислотой.
Хиноны обладают высокой реакционной способностью. Направления их превращений предсказуемы: они реагируют как кетоны и одновременно по карбонильной группе и двойным связям. Для них характерны реакции 1,4- и 1,6-присоединения
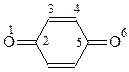
Хинон как кетон вступает в реакцию с гидроксиламином с образованием моно- и диоксима
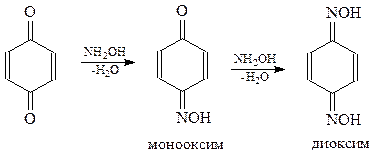
Хиноны вступают в многочисленные реакции присоединения.
Присоединение брома происходит по 3,4-положению п-хинона. Образующийся при этом дибромид легко отщепляет молекулу бромистого водорода и дает замещенный хинон
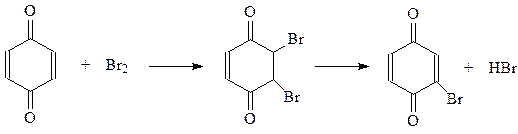
Аналогично протекает присоединение диенов. В реакции Дильса-Альдера хиноны выступают как диенофилы
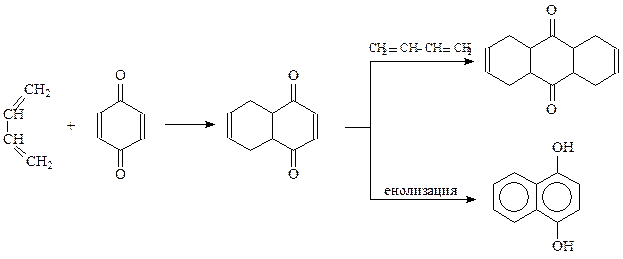
Однако хиноны и сами могут реагировать по 1,3-положению подобно диенам с сопряженными двойными связями. Примером такой реакции является присоединение к хинонам галогенводородных кислот
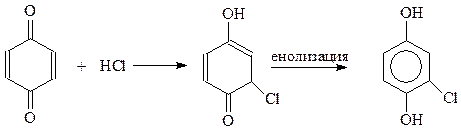
Аналогично присоединяется к хинону и уксусный ангидрид.
Примером реакции 1,6-присоединения является присоединение водорода с образованием двухатомных фенолов
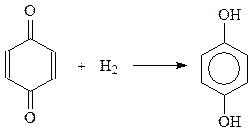
Дата добавления: 2014-12-24; просмотров: 11801;
