Изотермы Ван-дер-Ваальса и их анализ.
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса— кривые зависимости 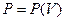 при заданных значениях
при заданных значениях 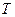 , определяемые уравнением Ван-дер-Ваальса (2.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют своеобразный характер. При высоких температурах (
, определяемые уравнением Ван-дер-Ваальса (2.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют своеобразный характер. При высоких температурах ( 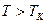 ) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре
) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре 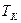 на изотерме имеется точка перегиба
на изотерме имеется точка перегиба 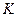 . Эта изотерма называется критической,соответствующая ей температура
. Эта изотерма называется критической,соответствующая ей температура 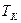 — критической температурой.Критическая изотерма имеет лишь одну точку перегиба
— критической температурой.Критическая изотерма имеет лишь одну точку перегиба 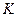 - называемую критической точкой;в этой точке касательная к изотерме параллельна оси абсцисс. Соответствующие этой точке объем
- называемую критической точкой;в этой точке касательная к изотерме параллельна оси абсцисс. Соответствующие этой точке объем 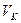 и давление
и давление 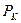 называются также критическими.Состояние с критическими параметрами (
называются также критическими.Состояние с критическими параметрами ( 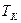 ,
,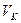 ,
,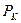 ) называется критическим состоянием.При низких температурах (
) называется критическим состоянием.При низких температурах ( 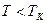 ) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь. 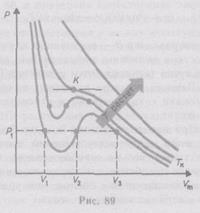
Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса (3) к виду:
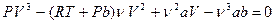 . (3.1)
. (3.1)
В таком виде уравнение, при заданных 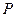 и
и 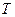 , является уравнением третьей степени относительно
, является уравнением третьей степени относительно 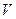 .
.
Кубическое уравнение может иметь либо три вещественных корня, либо один вещественный и два мнимых. Причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа 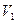 ,
, 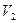 и
и 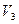 отвечают одному значению давления
отвечают одному значению давления 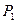 ), второму случаю— изотермы при высоких температурах.
), второму случаю— изотермы при высоких температурах.
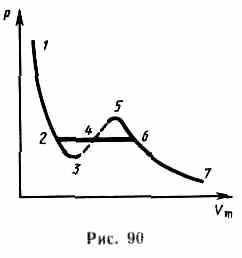 Рассматривая различные участки изотермы при
Рассматривая различные участки изотермы при 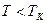 (рис.90), видим:
(рис.90), видим:
на участках 1—3 и 5—7 при уменьшении объема 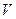 давление
давление 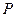 возрастает, что соответствует естественному поведению газа;
возрастает, что соответствует естественному поведению газа;
на участке 3—5 сжатие вещества приводит к уменьшению давления; практика показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы.
Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—1.
Часть 7—6 — отвечает газообразному состоянию;
часть 2—1 — жидкому;
часть 6—2, — горизонтальный участок, соответствующий равновесию жидкой и газообразной фаз вещества.
Вещество в газообразном состоянии при температуре ниже критической называется паром,а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса (1813—1885), изучавшего изотермическое сжатие углекислого газа. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные.
Для нахождения критических параметров подставим их значения в уравнение (3.1) и запишем для одного моля:
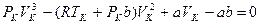 (3.2)
(3.2)
Поскольку в критической точке все три корня совпадают и равны 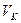 , уравнение приводится к виду
, уравнение приводится к виду
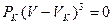 , или
, или 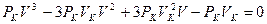 . (3.3)
. (3.3)
Так как уравнения (3.2) и (3.3) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать:
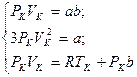 Решая полученную систему уравнений, найдем:
Решая полученную систему уравнений, найдем:
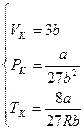 . (4)
. (4)
Если решить систему относительно постоянных величин 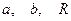 , получаем:
, получаем:
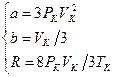 .
.
Полученные соотношения показывают, что для каждого реального газа необходимо вычислять его индивидуальную газовую постоянную 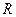 , которая отличается от молярной газовой постоянной
, которая отличается от молярной газовой постоянной 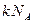 причем оказывается индивидуальная газовая постоянная меньше, чем молярная. Поскольку газовая постоянная пропорциональна числу молекул в моле, заключаем, что в критическом состоянии происходит уменьшение структурных единиц, образующих газовую постоянную, т.е. молекулы объединяются в комплексы. При удалении от критического состояния эти комплексы распадаются, и индивидуальная газовая постоянная становится равной молярной.
причем оказывается индивидуальная газовая постоянная меньше, чем молярная. Поскольку газовая постоянная пропорциональна числу молекул в моле, заключаем, что в критическом состоянии происходит уменьшение структурных единиц, образующих газовую постоянную, т.е. молекулы объединяются в комплексы. При удалении от критического состояния эти комплексы распадаются, и индивидуальная газовая постоянная становится равной молярной.
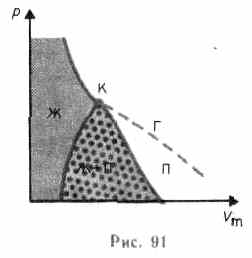 Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 91), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 91), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму 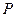 ,
,  под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 92), видим, что последняя имеет прямолинейный  участок 2—6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабильными.
участок 2—6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабильными.
Участок 2—3 изображает перегретую жидкость,
5—6—пересыщенный пар.Обе фазы ограниченно устойчивы.
При достаточно низких температурах изотерма пересекает ось 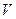 , переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости,участок 9— 10 — растянутой жидкости.
, переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости,участок 9— 10 — растянутой жидкости.
Дата добавления: 2019-10-16; просмотров: 1637;
