Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса (61.2) к виду
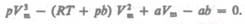 (62.1)
(62.1)
Уравнение (62.1) при заданных р и Т является уравнением третьей степени относительно Vm; следовательно, оно может иметь либо три вещественных корня, либо
| и |
один вещественный b два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа V1,V2 и V3 отвечают (символ «m» для
простоты опускаем) одному значению давления р1), второму случаю — изотермы при высоких температурах.
Рассматривая различные участки изотермы при Т<Тk (рис. 90), видим, что на
участках 1—3 и 5—7 при уменьшении объема Vm давление р возрастает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—/. Часть б—7 отвечает газообразному состоянию, а часть 2—/ — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется

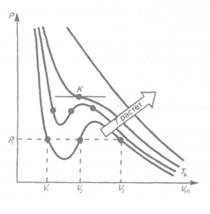
|

|
Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса (1813—1885), изучавшего изотермическое сжатие углекислого газа. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные.
Дата добавления: 2017-04-20; просмотров: 509;
