Факторы, влияющие на скорость химической реакции
Кинетика химических реакций. Катализ
Химическая кинетика
Учение о скоростях химических реакций называется химической кинетикой.
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции зависит от природы реагирующих веществ, концентрации реагентов, температуры, катализаторов, давления, степени измельчения (для твердых веществ), среды, формы реактора и т. д.
Зависимость скорости реакции от концентрации определяется законом действия масс (закон скорости):
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
U = k[A][B], где
k – коэффициент пропорциональности или const скорости реакции
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
[A], [B] – концентрации реагирующих веществ
Факторы, влияющие на скорость химической реакции
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ;
2) температура;
3) катализатор;
4) ингибитор.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ.
Константа скорости реакции I порядка:
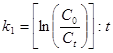
Для реакции II порядка константа скорости реакции: 
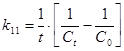
Константу скорости реакции для реакции I порядка можно определить по периоду полураспада:
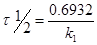
Каждая реакция характеризуется определенным энергетическим барьером для его преодоления необходима энергия активации 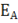 – некоторая избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому увеличению скорости реакции.
– некоторая избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому увеличению скорости реакции.
Зависимость const скорости реакции k от энергии активации ( 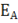 , Дж/моль) выражается уравнением Аррениуса:
, Дж/моль) выражается уравнением Аррениуса:
Расчет энергии активации:
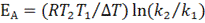
Катализ – этопроцесс, который заключается в изменении скорости химических реакций в присутствии веществ, называемых катализаторами.
Катализатор– это вещество, которое изменяет скорость химической реакции и участвует в ней, входит в состав промежуточных продуктов и после окончания реакции остается неизменным.
Катализаторы: соли, кислоты, оксиды, металлы. Могут находится в любом из трех агрегатных состояниях.
Классификация каталитических реакций:
1. положительный или отрицательный катализ
Положительный катализ – катализ, при котором скорость химической реакции увеличивается.
Отрицательный катализ – катализ, при котором скорость химической реакции уменьшатся.
Вещества, уменьшающие скорость химической реакции, называется ингибиторами.
2. Автокатализ
В этом случае катализатором может быть один из продуктов реакции.
Например: СН3 – СООС2Н5 + Н2О = СН3 СООН + С2Н5ОН.
Данная реакция катализируется уксусной кислотой.
3. гомогенный и гетерогенный катализ.
Гомогенный катализ – катализ, когда катализатор и реагирующие вещества находятся в одной фазе.
Гетерогенный катализ – катализ, когда катализатор и реагирующие вещества находятся в разных фазах.
Чаще всего катализатор – твердое вещество, а реагирующие вещества – жидкости или газы.
Принципы выполнения каталитических реакций
· катализатор не влияет на термодинамические равновесия, то есть не смещает равновесия, а только ускоряет как прямую, так и обратную реакцию и сокращает время достижения равновесия.
· количества катализатора.
· Присутствие посторонних веществ. Некоторые вещества могут усиливать и активировать действие катализатора. Такие вещества называются промоторами. Вещества, которые снижают активность катализатора или отравляют его, называют ядами (соединения серы, фосфора, мышьяка, ртуть, оксид углерода (2), свободные галогены).
· Влияние температуры. У каждого катализатора своя определенная температура. (Отклонение температуры как в одну, так и в другую стороны снижают активность катализаторов).
· Влияния давления
Применение гомогенного катализа
1. промышленность органического синтеза
2. пищевой промышленности
3. фармацевтической промышленности
4. получения полимеров
5. гидролиз эфиров
Применение гетерогенного катализа
1. производство серной кислоты;
2. синтез аммиака;
3. синтез метилового спирта;
4. крекинг нефти;
5. металлургическая промышленность.
Катализатор характеризуется:
Активностью – относительное ускорение реакции под влиянием катализатора (Вк)
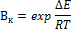
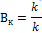
Производительность – характеристика ускоряющего действия твердого катализатора на производстве (Пк)
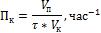
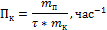
Селективность– характеристика направленности действия катализатора (Sк)
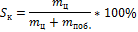
| <== предыдущая лекция | | | следующая лекция ==> |
| Понятие ресурсы, их классификация. Использование ресурсов и проблемы загрязнения среды. Проблемы биологических ресурсов | | | Формирование спинномозговых нервов |
Дата добавления: 2019-07-26; просмотров: 256;
