Реальные газы. Уравнение Ван-дер-Ваальса
В реальных газах молекулы имеют конечный объём и связаны между собой силами взаимодействия. При расчете состояний реальных газов нашло широкое применение следующее отношение:
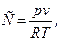 (19)
(19)
где С - коэффициент сжимаемости;
p - абсолютное удельное давление, Па;
v - удельный объём газа, 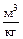 ;
;
R - удельная газовая постоянная, 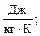
T – абсолютная термодинамическая температура, К.
Для идеальных газов С=1, следовательно, при подстановке этого значения в уравнение (1) будем иметь известное уравнение состояния идеального газа:
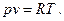
Одной из попыток (и удачной) аналитически описать свойства реальных газов является уравнение, предложенное Ван-дер-Ваальсом. За основу им было выбрано уравнение состояния идеального газа (уравнение 2), в которое введены поправки, учитывающие отличие реального газа от идеального. Первая поправка зависит от объема самих молекул. Представим уравнение (2) в виде
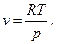 (20)
(20)
Для идеального газа, если p→∞, то v→0. Для реального газа, молекулы которого имеют собственный объём vмол, а также имеют объём зазоров при упаковке vзаз, свободный минимальный объём В, до которого можно сжать газ, будет равен
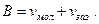 (21)
(21)
С учетом этого, уравнение 3 принимает вид
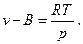
Величина В для каждого газа имеет вполне определённое значение.
Из уравнения (5) выразим удельное абсолютное давление
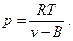 (22)
(22)
Таким образом, при одинаковых условиях (температуре) давление в реальном газе будет больше, т.к. свободный объём будет меньше на величину В, при этом длина свободного пробега молекул будет меньше, следовательно, число соударений молекул больше.
Вторая поправка учитывает влияние сил взаимодействия между молекулами. При наличии этих сил давление в реальном газе будет меньше, так как молекулы соседними частицами будут притягиваться в глубь сосуда. Причем, поправка давления будет прямо пропорциональ-на как числу притягиваемых, так и числу притягивающих молекул. Иначе говоря, она будет прямо пропорциональна квадрату их плотнос-ти. Отсюда можно записать
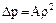 , (23)
, (23)
где ∆p - поправка на давление, учитывающая силы взаимодействия между молекулами;
А - коэффициент пропорциональности, принимающий для каждого
газа определенное числовое значение, не зависящее от параметров состояния;
ρ - плотность газа.
Введя вторую поправку в уравнение (6), имеем
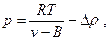
или
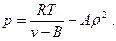 (24)
(24)
Учитывая, что произведение плотности на удельный объем равно единице, уравнение (9) можно записать следующим образом:
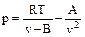 (25)
(25)
Отсюда уравнение Ван-дер-Ваальса принимает вид
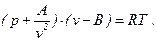 (26)
(26)
Это уравнение было опубликовано Ван-дер-Ваальсом в 1873 г.
Величину 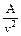 называют внутренним давлением, для жидкостей оно принимает очень большое значение (для воды при T=293 K оно составляет примерно 10800 бар), для газов оно сравнительно невелико и зависит от давления и температуры газа.
называют внутренним давлением, для жидкостей оно принимает очень большое значение (для воды при T=293 K оно составляет примерно 10800 бар), для газов оно сравнительно невелико и зависит от давления и температуры газа.
Уравнение Ван-дер-Ваальса качественно отображает поведение реальных веществ в жидком или газообразном состоянии. Для двухфазных состояний оно неприменимо.
Вопросы для самопроверки
1 Чем отличаются реальные газы от идеальных?
2 Что называется коэффициентом сжимаемости?
3 Как в уравнении Ван-дер-Ваальса учитывается наличие собственного объема молекул?
4 Как в уравнении Ван-дер-Ваальса учитывается наличие сил взаимодействия между молекулами?
5 Какая величина называется внутренним давлением?
6 Для каких состояний рабочего тела применимо это уравнение?
Водяной пар
Основные понятия и определения
Водяной пар широко используется в энергетике, отоплении, для различных технических нужд. Он является рабочим телом в тепловых двигателях (паровых поршневых машинах, паротурбинных установках), а также в различных нагревательных устройствах (теплообменных аппаратах, в нагревательных приборах парового отопления, в калориферах и т. д.), где он используется в качестве теплоносителя.
Процесс парообразования может осуществляться двумя различными по интенсивности и характеру процессами:
1. Испарение – процесс парообразования с поверхности жидкости. Здесь при хаотическом тепловом движении отдельные молекулы, обладающие наибольшей скоростью, преодолевают поверхностное натяжение и вылетают в пространство над поверхностью раздела. Испарение может быть полным, если над жидкостью – неограниченное пространство.
2. Кипение – процесс одновременного и многократного испарения жидкости в область, образованную паровым пузырьком.
Для возникновения кипения температура жидкости должна несколько превышать температуру кипения при данном давлении, т.е. должен быть местный перегрев этой жидкости. При отводе тепла от пара он будет вновь превращаться в жидкость. Этот обратный процесс называется конденсацией. Процесс кипения, так же как и процесс конденсации, протекает при постоянной температуре, если при этом давление рабочего тела не меняется. Жидкость, полученную при конденсации пара, называют конденсатом.
Полученные пары бывают насыщенными и перегретыми.
Насыщенный пар получается в том случае, если в закрытом сосуде наступает момент, когда количество молекул, вылетающих из жидкости, равно числу молекул, возвращающихся обратно в жидкость. Пар в этом состоянии принимает максимальную плотность при данной температуре. То есть, можно сказать, что насыщенный пар – это пар, соприкасающийся с жидкостью и находящийся с ней в термическом равновесии. С изменением температуры равновесие нарушается, вызывая изменение плотности и давления насыщения.
Насыщенные пары, в свою очередь, можно разделить на 2 группы:
1) сухие насыщенные пары;
2) влажные насыщенные пары.
Сухой насыщенный пар получается в результате законченного парообразования, т.е. когда последняя капля жидкости перешла в пар. Это состояние рабочего тела является неустойчивым, т.к. при отводе тепла (или повышении температуры, или повышении давления) часть пара сконденсируется, и рабочее тело будет состоять из смеси пара с жидкостью. Такой пар будет называться влажным насыщенным. Влажный пар может рассматриваться как смесь сухого пара с мельчайшими капельками воды, взвешенными в паре. Его состав определяется степенью сухости x, которая представляет собой долю сухого пара во влажном. Следовательно, (1-х) – влажность пара. (Например, если степень сухости влажного пара х=0,75, то следует, что в рабочем теле 75% сухого пара и 25% - воды).
При незначительном повышении температуры или понижении давления сухой насыщенный пар переходит в состояние перегретого пара, отсюда при одном и том же давлении температура и объем перегретого пара будет больше соответствующих величин сухого пара. Чем больше степень перегрева, тем больше по своим термическим свойствам перегретый пар приближается к идеальному газу. Напротив, при приближении к состоянию насыщения все больше проявляется влияние конечного объема молекул и Ван-дер-Ваальсовых сил.
Пар различного состояния в промышленных условиях получается в паровых котлах (парогенераторах). Процесс парообразования протекает при постоянном давлении, т.е. является изобарным.
Как уже отмечалось, процесс производства пара идет при постоянном давлении. Он включает в себя три последовательных этапа:
- подогрев воды до температуры кипения (она еще называется температурой насыщения и обозначается Ts);
- парообразование, т.е. превращение кипящей жидкости в сухой насыщенный пар;
- перегрев пара до необходимой температуры.
Дата добавления: 2019-04-03; просмотров: 582;
