Особенности строения твердых тел.
Виды химических связей в веществах, применяемых при создании материалов.
В веществах различают три основных типа химических связей: ковалентную, металическую и молекулярную (Вандервальса). Ковалентная связь представляет собой связь, образованную за счет спаривания валентных электронов средних атомов и прикрытия электронных оболочек. Главным представителем вещества обладающим ковалентной связью - водород. Металическая связь: данный вид связи присутствует в системах, состоящих из положительных атомов, находящихся в среде обобществленных электронов, которые представляют собой электронный газ. При этом целостность вещества обусловлена притяжением между положительными атомами и отрицательными электронам. По сравнению с ковалентной связью, металлическая связь характеризуется меньшей энергией и из-за больших межатомных расстояний вещества обладающие металлической связью обладают большей пластичностью. Ионная связь: вид химической связи присутствует в веществах, вмещающих металлические и металлоидные атомы. При данном виде химической связи происходит переход валентных электронов от металлического атома к металлоидному и возникновению электростатического притяжения. Данный вид химической связи характерен для ионов кристаллов. Молекулярная связь (Вандервальса): данный вид химической связи наблюдается в ряде веществ между молекулами, имеющими ковалентный характер внутри молекулярного взаимодействия. При этом возникает межмолекулярное притяжение, обусловленное согласованным движением валентных электронов в соседних молекулах. Благодаря этому движение возникает система связанных электрических дифурий. Схема образования межмолекулярных связей: 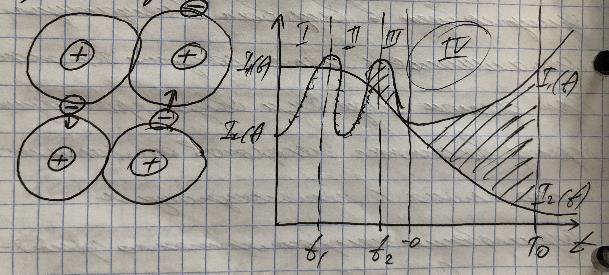
Тела, обладающие молекулярной связью, как правило, представляют из себя кристаллы углеводорода или кристаллы инертных газов.
Особенности строения твердых тел.
Большая часть материалов в микроэлектронике находится в твердом состоянии. В зависимости от особенности строения вещества могут иметь кристаллы или аморфную структуру. Кристаллические вещества: к этой группе веществ относят вещества с упорядоченным внутренним строением, которое описывается структурой кристаллической решетки. Кристаллическая решетка представляет собой периодическую объемную конфигурацию при этом в узлах объемной решетки располагаются атомы, ионы и молекулы. Расстояния между узлами кристаллической решетки, углы между ее гранями и расположение в ней атомов, ионов и молекул в основном определяет физические свойства материала. Для описания структуры кристаллической решетки используют так называемые индексы Миллера. 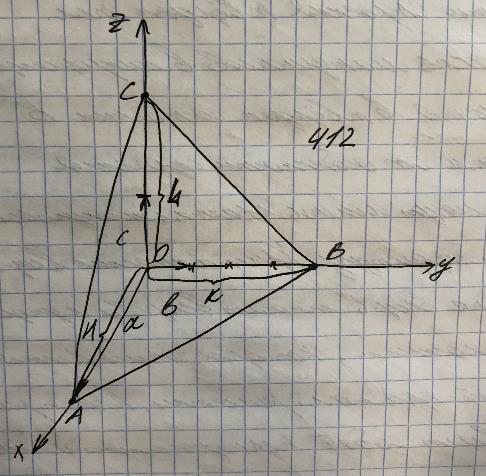
На рисунке малыми латинским буквами обозначены периоды трансляции, соответсвующее положение любой плоскости в кристалле может быть определено по трем точкам: А, В, С. Величины отрезков ОА, ОВ, ОС обозначены соответственно H, K, L. Обратные величины H0=1/H=h; K0=1/K=k; L0=1/L=l. Наименьшие целые числа имеющие такое же соотношение, как H0, K0, L0 обозначаются h, k, l - индексы Миллера, которые применятся для обозначения плоскостей в кристаллических веществах. Соответсвенно для обозначения приведенных на рисунке плоскости индексы Миллера указывают 412:
H=1, K=4, L=2 и H0=1, K0=1/4, L0=1/2.
Лекция №2.
Дата добавления: 2019-04-03; просмотров: 746;
