Редкоземельные металлы
Наиболее широко в технологии редких металлов ионный обмен применяют для разделения лантаноидов. Лишь с освоением этого метода удалось получить количества индивидуальных редкоземельных металлов, достаточные для изыскания возможностей их технологического применения. При пропускании раствора смеси солей РЗЭ через колонку, наполненную катионитом, происходит частичное разделение благодаря различной способности к ионному обмену. Ионообменное разделение основано на том, что постепенное уменьшение радиуса иона (и соответствующее понижение основности) приводит к постепенному упрочнению связи с гидратной оболочкой. Поскольку в основе прочности связывания катионов с анионными группами ионообмен-ников лежит, по-видимому, электростатическое притяжение гидратированного катиона к отрицательной группировке, то оказывается: чем больше радиус гидратированного иона, тем менее прочно он связывается. В ряду РЗЭ, таким образом, ряд сродства к катиониту имеет вид: La3+>Ce3+>Pr3+> ... ^Dy3+>Y3+>Ho3+> ... >Lu3+>Sc3+.
Если медленно пропускать раствор, содержащий некоторые ионы лантаноидов, через колонку с катионообменной смолой, то тяжелые ионы проходят через нее первыми.
Однако коэффициенты распределения соседних ионов в системе: катионит в Н+- форме - смесь РЗЭ настолько близки, что для их удовлетворительного разделения потребовалось бы огромное число теоретических тарелок колонки. Повысить коэффициенты селективности можно за счет ввода в водную фазу комплексообразующих и хелатных агентов. Прочность образующихся комплексов обычно увеличивается по мере уменьшения ионного радиуса, поскольку процесс комплексообразования сопровождается внедрением лиганда в первую координационную сферу (с вытеснением гидратирующей воды). Поэтому образование комплексных соединений (уменьшающих сорбируемость иона) усиливает эффект первичного разделения - наименее сорбирующиеся ионы образуют более прочные комплексы. Очевидно, эффективность разделения тем выше, чем сильнее различаются константы комплексообразования соседних ионов.
Число опробованных комплексообразующих реагентов в настоящее время значительно. На рис. 54 представлена зависимость константы устойчивости комплексов типа LnA с различными лигандами от атомного номера РЗЭ. Как видно из приведенных данных, практически во всех случаях с увеличением атомного номера растет константа устойчивости комплекса.
Наиболее часто в практике разделения РЗЭ используют лимонную, нитрилотриуксусную и этилендиаминтетрауксусную кислоту.
Спеддинг впервые предложил использовать для ионообменного разделения цитрат-ион. Лимонная кислота (СН2СООН)2С(ОН)СООН взаимодействует с ионами РЗЭ, образуя осадок нормальных цитратов, которые растворяются в минеральных кислотах, щелочах и избытке цитрата щелочного металла. Равновесие в системе сложное, образование комплексов различного состава представлено на рис. 55.
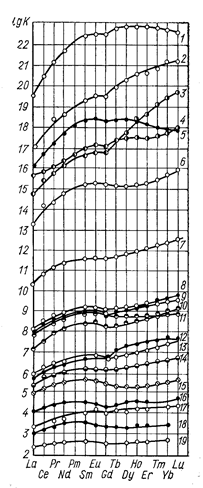
Рис. 54. Зависимость константы устойчивости комплексов LnA от атомного номера РЗЭ (Химия комплексных соединений редкоземельных элементов, 1966, с. 51, рис. 18.): 1 -диэтилентриаминпентаацетат; 2 - гидроксокомплексы, гидроксиэтилэти-лендиаминтриуксусная кислота; 3 – этилендиаминтетраацетат; 4 - 2,2’’-биc(дикарбоксиметил) аминоэтиловый эфир; 5 - 1,2-бис(2-дикарбоксиметиламиноэтокси)этанол; 6 - гидроксиэтилэти лендиаминтриуксусная кислота; 7 - нит рилотриацетат; 8 - пиколилиминодиацетат; 9 - гексаметилендиаминтетрауксусная кислота; 10 - этилендиаминдиацетат; 11- дипиколинат; 12 – метилпиколилиминодиацетат; 13 - ими-нодиацетат; 14 – пиперидиндикарбонат; 15 – дигликолят; 16 - малат; 17 – глицинат; 18 - тартрат; 19 - гликолят.
| Повышение концентрации лимонной кислоты ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® | |||
| Повышение рН ¾¾¾¾¾¾ | Ln(H2Cit)2+ ¾¾¾¾® | Ln(H2Cit)2+ ¾¾¾¾® | Ln(H2Cit)3+ |
| Ln(HCit) + ¾¾¾¾¾¾ | ¾¾¾¾¾¾¾¾® | Ln(HCit)21- | |
| Ln(Cit)0 ¾¾¾¾® | Ln2(Cit)32+ ¾¾¾¾® | Ln(H2Cit)23- | |
| Ln4(Cit*)30 ¾¾¾¾® | Ln(Cit*)1- |
Рис. 55. Схема образования цитратных комплексов: Ln - ион лантаноида; Cit – C6Н5О73-, Cit* - C6Н4О74-.
Значения логарифма константы устойчивости цитратных комплексов вида Ln(Cit)23- (m =0,001-0,025, t=20° С) приведены ниже:
| La | 9,45 | Pr | 9,75 |
| Ce | 9,65 | Eu | 9,80 |
Спеддинг получил хорошее разделение с помощью цитратов, но оказалось невозможным получить растворы значительной концентрации по редкоземельному элементу. Объясняется это малой растворимостью в воде солей типа Ln(Cit).2H2O (особенно цериевой группы), поэтому для успешного проведения процесса применяли растворы с концентрацией 5.10-3М H3Cit при pH»8. В этих условиях процесс близок к проявительной, а не к вытеснительной хроматографии, следовательно, загрузка колонки (процент использования смолы на стадии сорбции) должна быть незначительной.
Фитч и Рассел применили для элюирования растворы нитрилотриуксусной кислоты (НТА): N(CH2COOH)3. Это слабая кислота, отрицательные логарифмы констант диссоциации которой равны соответственно: pK1=l,89; pK2=2,49; pK3=9,73.
Выпускаемая в продажу трехзамещенная натриевая соль называется трилоном А или комплексоном I.
При низких значениях рН в растворе образуются комплексы состава Ln(HTA)0; при рН>4 Ln(HTA)23-. При рН<4 возможно образование комплексов LnH(HTA)+; LnH2(HTA)2+; LnH2(HTA)21-. В щелочной среде в комплексообразовании принимает участие ион гидроксила.
Сорбцию обычно производят на смоле в NH4+-форме (для чего ее предварительно промывают раствором NH4Cl). При этом перед разделением необходима тщательная отмывка от С1-, ухудшающего разделение.
Хорошие результаты получены при элюировании 0,5%-ным раствором НТА с рН=4-6. Ниже приведены значения логарифма константы устойчивости комплексов типа Ln[HTA]° (m =0,1, 20°С):
| La | 10,37 | Pr | 11,07 |
| Ce | 10,83 | Eu | 11,49 |
Викери впервые применил для разделения РЗЭ растворы этилендиаминтетрауксусной кислоты (ЭДТА) (СН2)2N2(СН3СООН)4, которая образует в растворе ряд комплексов с Ln:
HLnЭДТА0 ® LnЭДТА1- ® LnЭДТА(ОН)2-
¾¾¾¾¾¾¾¾¾¾¾®
повышение рН
В продажу обычно выпускают двузамещенную натриевую соль, называемую трилоном Б или комплексоном III.
Изменяя рН и концентрацию реагентов, можно получить комплексы другого состава. Ниже приведены значения логарифма константы устойчивости комплексов типа LnЭДТА1- (m=0,1; t=20°C):
| La | 15,1 | Tb | 17,60 |
| Ce | 15,8 | Dy | 18,0 |
| Pr | 16,2 | Ho | 18,1 |
| Nd | 16,4 | Er | 19,0 |
| Pm | 16,75 | Tm | 18,6 |
| Sm | 16,90 | Yb | 18,7 |
| Eu | 17,30 | Lu | 19,1 |
| Gd | 17,10 | Y | 17,8 |
Применение смолы в Н+-форме может привести к высаливанию ЭДТА в слое смолы (из-за небольшой растворимости ЭДТА в кислых растворах), поэтому смола переводится в аммониевую форму. Для предотвращения выпадения ЭДТА приходится применять элюирующие растворы низкой концентрации или повышать рН добавлением щелочи. Однако в щелочных растворах возможно образование малорастворимых солей типа Ln2ЭДТА(ОН)2. Хорошие результаты получены для растворов. ЭДТА с рН=4,2 и 6,8.
Для предотвращения выпадения ЭДТА и НТА в кислых растворах смолу предварительно обрабатывают ионами, образующими с элюентами-комплексообразователями стабильные, растворимые комплексы. Для этой цели применяют ионы Fe3+ или Cu2+. Процесс разделения ионов РЗЭ удобно организовать следующим образом. Вся порция смолы делится на две части и помещается в отдельные колонки. Первая колонка («коллекторная») насыщается разделяемыми ионами (до равновесия с исходным раствором), а вторая («разделительная») - ионами меди (пропусканием раствора CuCl2). После отмывки от С1- обе колонки соединяются последовательно (коллекторная колонка - первой). На вход коллекторной колонки подается раствор комплексообразователя. Рассмотрим процессы, протекающие в смоле.
Для упрощения предположим, что в растворе содержится только два типа ионов, подлежащих разделению (Ln13+ и Ln23+), в равном соотношении. При этом считаем, что ионы Ln13+ образуют с элюирующим агентом (ЭДТА) более прочный комплекс. Состав элюирующего раствора берется таким, чтобы обеспечивалось образование комплексов РЗЭ:ЭДТА=1:1, что характерно для растворов ЭДТА с рН=7-8. Из-за большой близости констант обмена гидратированных ионов РЗЭ не происходит их заметного разделения при насыщении коллекторной колонки. Поэтому и в смоле соотношение Ln13+: Ln23+ = =1:1. Поступая в коллекторную колонку, первая порция элюента вытесняет из верхней части фильтрующего слоя содержащиеся в нем ионы Ln13+ и Ln23+. Последние, перейдя в раствор, свяжутся в прочные комплексные анионы, а их место в смоле займут ионы аммония (при нейтрализации аммиаком раствора ЭДТА до рН=7-8 в растворе существует трехзамещенная аммониевая соль (NH4)3HY[1]):
| ½ | ½ | |||
| ½ | Ln1 | ½ | H[Ln1Y] | |
| R | ½ | + 2(NH4)3HY « R | ½ | (NH4)6 + |
| ½ | Ln2 | ½ | H[Ln2Y] | |
| ½ | ½ |
Раствор комплексных кислот, перемещаясь по слою, вступает во взаимодействие с лежащими ниже слоями смолы, и ионы РЗЭ перераспределяются. Из комплексных кислот вытесняется ион Ln23+, поскольку прочность его соединения с лигандом меньше. В результате такого перераспределения раствор и катионит обогатятся соответственно ионами Ln13+ и Ln23+:
| ½ | ½ | |||
| ½ | (Ln1)2 H[Ln1Y] | ½ | Ln1 H[Ln1Y] | |
| R | ½ | + « R | ½ | + |
| ½ | (Ln2)2 H[Ln2Y] | ½ | (Ln2)3 H[Ln2Y] | |
| ½ | ½ |
При дальнейшем перемещении по коллекторной колонке состав первой порции раствора изменяется до момента установления окончательного равновесия, которое определяется в основном различием в прочности образующихся комплексных анионов. Это легко показать, исходя из следующего. Уравнение изотермы ионного обмена для равновалентных ионов имеет вид
A1/A2 = K1,2 . m1/m2
где А - содержание разделяемых ионов в катионе; m - концентрация свободных (распределяемых) ионов в растворе.
Концентрация свободных ионов в растворе можно выразить через константы нестойкости комплексов:
[Ln3+] = Kн[LnY-]/[Y4-]
тогда
A1/A2 = K1,2 . Kн’[Ln1Y-] / Kн’’[Ln2Y-]
При достаточно большой прочности комплексов [Ln1Y-]»C1 (С - аналитическая концентрация ионов Ln в растворе):
A1/A2 = K2,1 . Kн’C1 / Kн’’C2
Отсюда соотношение разделяемых ионов в равновесном со смолой растворе:
C1/C2 = K2,1 . Kн’’A1 / Kн’A2
Поскольку свойства ионов соседних РЗЭ близки, можно принять K2,1»1, и степень обогащения равновесного раствора ионами одного из РЗЭ будет тем больше, чем больше различие в константах нестойкости комплексов.
С момента установления равновесия дальнейшее обогащение раствора ионами Ln1Y- прекращается. Высота слоя смолы определяет лишь объем равновесного раствора, который тем больше, чем больше высота колонки.
Последние порции фильтра обогащаются ионами РЗЭ, образующими с ЭДТА менее прочный комплекс. При достаточной высоте колонки эти фракции могут содержать только ионы Ln23+ (процесс, обратный фронтальному анализу).
В разделяющем слое, насыщенном ионами меди, при прохождении раствора, обогащенного ионами Ln13+, происходит дальнейшее разделение.
В первом слое смолы:
| ½ | ½ | |||
| ½ | 3H[Ln1Y] | ½ | (Ln1)3 2Cu[CuY] | |
| R | ½ | Cu6 + « R | ½ | + |
| ½ | H[Ln2Y] | ½ | Ln2 2H2 [CuY] | |
| ½ | ½ |
| ½ | ½ | |||
| ½ | (Ln1)3 3H[Ln1Y] | ½ | (Ln1)2 | |
| R | ½ | + « R | ½ | + 4H[Ln1Y] |
| ½ | Ln2 H[Ln2Y] | ½ | (Ln2)2 | |
| ½ | ½ |
| ½ | ½ | |||
| ½ | (Ln1)2 3H[Ln1Y] | ½ | (Ln1)2 3H[Ln1Y] | |
| R | ½ | + « R | ½ | + |
| ½ | (Ln2)2 H[Ln2Y] | ½ | (Ln2)2 H[Ln2Y] | |
| ½ | ½ |
Во втором слое:
| ½ | ½ | |||
| ½ | 2Cu[CuY] | ½ | 2Cu[CuY] | |
| R | ½ | Cu6 + « R | ½ | Cu6 + |
| ½ | 2H2[CuY] | ½ | 2H2 [CuY] | |
| ½ | ½ |
| ½ | ½ | |||
| ½ | ½ | 2Cu[CuY] | ||
| R | ½ | Cu6 +3H[Ln1Y] « R | ½ | (Ln1)4 + |
| ½ | ½ | 2H2 [CuY] | ||
| ½ | ½ |
| ½ | ½ | |||
| ½ | 2H[Ln1Y] | ½ | (Ln1)3 | |
| R | ½ | (Ln1)4 + « R | ½ | + 4H[Ln1Y] |
| ½ | H [Ln2Y] | ½ | Ln2 | |
| ½ | ½ |
В третьем слое:
| ½ | ½ | |||
| ½ | 2Cu[CuY] | ½ | 2Cu[CuY] | |
| R | ½ | Cu6 + « R | ½ | Cu6 + |
| ½ | 2H2[CuY] | ½ | 2H2 [CuY] | |
| ½ | ½ |
| ½ | ½ | |||
| ½ | 2Cu[CuY] | ½ | 2Cu[CuY] | |
| R | ½ | Cu6 + « R | ½ | Cu6 + |
| ½ | 2H2[CuY] | ½ | 2H2 [CuY] | |
| ½ | ½ |
| ½ | ½ | |||
| ½ | ½ | 2Cu[CuY] | ||
| R | ½ | Cu6 +4H[Ln1Y] « R | ½ | (Ln1)4 + |
| ½ | ½ | 2H2 [CuY] | ||
| ½ | ½ |
Таким образом, происходит последовательное обогащение смолы ионами Ln13+ , завершающееся образованием их чистой зоны на границе с тормозящими ионами.
В настоящее время предложено большое число элюирующих растворов, часто содержащих смеси комплексообразователей и буферных веществ, способствующих поддержанию постоянного значения рН.
Обычно ионообменный метод не применяют для разделения всей суммы РЗЭ на индивидуальные элементы. Целесообразнее сочетать химические методы разделения (деление на цериевую и иттриевую группы осаждением двойных солей, выделение Се окислением, выделение La и промежуточных концентратов тонким регулированием рН, отделение Sm, Eu, Yb восстановлением) с предварительным хроматографическим разделением на узкие группы и хроматографической доочисткой индивидуальных элементов. Пример схемы комплексной переработки концентрата редкоземельных металлов представлен на рис. 56.
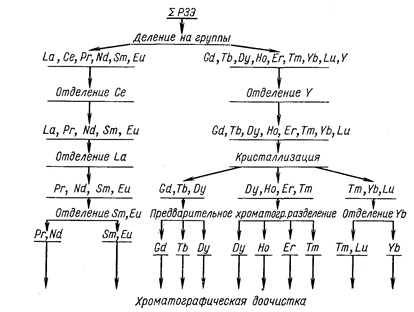
Рис. 56. Схема комплексной переработки группового концентрата РЗЭ.
Деление на группы можно осуществить осаждением двойных сульфатов типа R2(SО4)3.Na2SО4.2H2О. Двойные соли цериевой группы растворимы слабо (около 0,2 г редкоземельного окисла на литр раствора), в то время как соответствующие соединения металлов иттриевой группы растворимы полностью. Степень разделения в этом процессе невысока из-за образования смешанных кристаллов. На практике деление на группы этим методом можно осуществить следующим образом: к слабокислому раствору хлоридов или нитратов суммы РЗЭ (50-60 г/л по сумме металлов) на холоду при непрерывном перемешивании постепенно прибавляют порошкообразный сульфат натрия до образования осадка двойных сульфатов. Количество прибавляемого сульфата зависит от соотношения между подгруппами элементов в разделяемой смеси. Контроль за процессом разделения можно осуществлять по интенсивности линии неодима в желтой области спектра. Значительное ослабление интенсивности этой линии свидетельствует об окончании процесса образования двойных сульфатов металлов цериевой группы. В конце процесса пульпа нагревается до 70-80° С, что способствует более полному разделению.
Цериевая группа
Отделение церия
Двойные сульфаты цериевой группы переводят в гидроокиси обработкой небольшим избытком 40-50%-ного раствора едкого натра. Гидроокиси после отмывки можно растворить в любой минеральной кислоте.
Церий выделяют из смеси РЗЭ, используя различие в основности ионов Се4+ и трехвалентных РЗЭ. Четырехвалентный ион церия значительно менее основен, поэтому он осаждается из водных растворов при рН=3-4, тогда как трехвалентные РЗЭ не осаждаются вплоть до рН=6-8.
Окисление иона церия до четырехвалентного состояния может быть осуществлено обжигом окислов или сушкой гидроокисей на воздухе, в растворах — окислителями, например перманганатом, а также электролитически. Последующее введение в раствор основания до рН»3 обеспечивает достаточно селективное осаждение цериевого концентрата.
В промышленности применяется метод, состоящий в выщела-чивании высушенной на воздухе смеси гидроокисей РЗЭ разбавленной кислотой при рН=3-4. При этом в нерастворенном остатке концентрируется церий. Таким образом удается получить 95%-ный концентрат.
Выделение лантана
Предварительно выделив церий окислением, концентрат лантана получают медленным повышением рН кислого раствора оставшихся элементов цериевой группы. Значения рН осаждения гидроокисей из раствора хлоридов следующие: La3+- 8,03; Се3+ - 7,41; Pr3+- 7,05; Nd3+ - 7,02; Sm3+ - 6,83. Постепенным добавлением разбавленного раствора NН4OH к раствору хлоридов РЗЭ до рН » 7,5 переводят в осадок гидроокиси всех металлов, кроме лантана, который осаждается (после отделения суммы РЗЭ) добавлением избытка аммиака.
Следует учитывать, что добавление раствора щелочи всегда приводит к местным пересыщениям и неравномерному росту рН. Разделение при этом ухудшается. Тонкое регулирование рН во всем объеме раствора (создание равномерной концентрации осадителя) является трудной задачей. Для этого в производственных условиях чаще всего используют метод, предложенный Тромбом: воздух, предварительно барботированный через раствор аммиака (1 объем 25%-ного NН4OH + 3 объема Н2О) и насыщенный парами NН4OH, пропускают через раствор РЗЭ. Такая методика позволяет избежать местных повышений концентрации ОН--ионов и способствует постепенному понижению кислотности среды без сильного увеличения объема системы. В лабораторных масштабах с этой же целью можно использовать гидролиз мочевины. Образующийся при нагревании раствора мочевины аммиак выделяется равномерно по всему объему.
Отделение лантана можно также осуществить дробной кристаллизацией двойных нитратов аммония. Аммонийлантановый нитрат накапливается в наименее растворимых фракциях.
Выделение концентратов Sm - Еu
Способность Sm и Еu переходить в двухвалентное состояние используют для их отделения. Одним из возможных методов их концентрирования является электролиз растворов, подкисленных серной кислотой. При этом двухвалентные Sm и Еu образуют осадки сульфатов. В качестве катода обычно используют ртуть, а анодом могут служить платиновая пластинка, угольный стержень и т. п.
Электролиз с ртутным катодом в определенных условиях приводит к образованию амальгамы Sm и Еu. Вариантом процесса является контактирование амальгамы натрия с раствором РЗЭ, содержащим какой-либо комплексообразователь. При этом проходит обменная реакция:
Еu(СН3СОО)3 + Na (амальгама) ® Еu(СН3СОО)2 + NaCH3COO (амальгама);
Еu(СН3СОО)3 + Na (амальгама) ® Еu (амальгама) + 2NaCH3COO.
Практически процесс осуществляется встряхиванием в делительной воронке раствора лантаноидов с рассчитанным количеством амальгамы натрия. Амальгама РЗЭ разлагается подкислением:
SmЕu (амальгама) + 6СН3СООН ® Sm (ацетат) + Еu (ацетат) + Н2
Добавление смеси уксусной и серной кислот позволяет разделить Sm и Еu, так как более устойчивый в двухвалентном состоянии европий при этом выпадает в осадок в виде сульфата, а самарий переходит в раствор в виде ацетата трехвалентного иона.
Разделение полученных концентратов на индивидуальные РЗЭ и доочистку индивидуальных металлов в настоящее время производят методом ионного обмена с использованием перечисленных выше комплексообразователей. Метод ионного обмена часто применяют и для получения предварительных групповых концентратов после отделения основной массы церия и лантана.
Иттриевая группа
Отделение иттрия представляет собой трудную задачу. В отличие от церия, обладающего переменной валентностью, и лантана, несколько отличающегося от соседних с ним РЗЭ, иттрий очень близок по химическим свойствам к остальным членам группы, особенно к Dy, Но и Ег. Поэтому в данном случае задача состоит не в отделении превалирующего элемента в чистом виде и с высоким выходом, а в отделении хотя бы основной его массы. Обычно используют незначительные различия в растворимости феррицианидов иттрия и элементов иттриевой группы либо незначительные различия в их основности. В обоих случаях иттрий концентрируется в растворе, а феррицианиды или гидроокиси остальных элементов подгруппы осаждаются. Растворимость феррицианида иттрия в четыре раза превосходит растворимость соли эрбия.
Иттербий может быть отделен способами, аналогичными описанным для Sm и Ей. Предварительное разделение элементов иттриевой группы на подгруппы может быть проведено кристаллизацией броматов состава R(ВгО3)3.9Н2O. Броматы последних членов ряда более растворимы.
Техника процесса хроматографического разделения смесей РЗЭ состоит в основном в следующем. Катионит КУ-2 очищают от минеральных примесей обработкой его соляной кислотой и приводят в равновесие с промывающим раствором, для чего многократно повторяют контактирование катионита с раствором, рН которого равен рН промывающего раствора. Показателем окончания процесса является неизменность рН раствора при контакте со смолой. Подготовленный таким образом катионит переносят в колонку, изготовленную из стекла, пластмассы или металла (в последнем случае колонка обычно гуммируется).
В колонку с «равновесным» катионитом вносят возможно более нейтральный раствор хлоридов или нитридов РЗЭ, промывают колонку водой и подключают к ней сосуд с элюирующим раствором. Последний пропускают через колонку со сравнительно небольшой скоростью и собирают фильтрат (элюат) по порциям. В первых порциях фильтрата концентрируются наиболее тяжелые РЗЭ, затем элементы средней массы и т. д.
Хроматографическое поведение иттрия имеет аномальный характер: в зависимости от условий разделения он может занимать разные места в общем порядке вымывания РЗЭ. При вымывании растворами лимонной кислоты иттрий обычно занимает место между гольмием и диспрозием. Из полученных порций элюата РЗЭ осаждают щавелевой кислотой, осадок прокаливают до окислов.
Способность ионов РЗЭ образовывать в растворах комплексные анионы делает возможным применение для разделения анионообменников, однако в промышленном масштабе применяют в основном катионообменные смолы.
Дата добавления: 2019-04-03; просмотров: 1052;
