ДИНАМИКА СОРБЦИИ ИОНОВ В КОЛОНКАХ
В тех случаях, когда избирательность смол в данной системе не очень велика, для разделения двух (или более) веществ недостаточно одного контакта со смолой (однократного разделения). Этот процесс должен быть повторен многократно, что и осуществляется в ионообменных колонках.
Первой стадией процесса на колонках является поглощение ионов. Перед началом этой стадии ионит обычно содержит только один сорт способных к обмену ионов (для катионитов это чаще всего Н+ или NH4+ ).
Рассмотрим процесс поглощения ионов Na+ из раствора на колонке с сульфокатионитом в Н+-форме (рис. 41). Раствор NaCl вводят в верхнюю часть колонки. Когда первая порция поступающего раствора приходит в соприкосновение с верхним слоем ионнта, начинается обмен ионов, ионы Na+- поглощаются ионитом, а эквивалентное количество ионов водорода переходит из ионита в раствор. По мере поступления новых порция приходит в соприкосновение с новым слоем ионита - поглощение ионов Na+ продолжается и их концентрация в первой порции раствора уменьшается. В то же время первый слой смолы приходит в соприкосновение со второй порцией свежего раствора и поглощает при этом дополнительное количество ионов натрия и т. д. После того как некоторое количество раствора введено в колонку, верхние слои ионита приходят в равновесие с исходным раствором NaCl (т. е. состав раствора при прохождении этих «насыщенных» слоев не меняется). В идеальном случае при достаточной избирательности смолы по отношению к ионам Na+, концентрации его в растворе, превышающей определенный минимум, и достаточно медленном течении раствора можно считать, что ионов Н+ в первых слоях смолы практически нет - смола перешла в Na+- форму. Во всяком случае концентрация ионов натрия в растворе в верхней части колонки совпадает с их концентрацией в поступающем растворе (CNa+=Co), в то же время в нижней части колонки CNa+= 0. В средней части колонки происходит уменьшение концентрации ионов Na+ в растворе от Со до 0 - это зона обмена. Концентрация ионов Na+ в различных точках этой зоны различна и является функцией расстояния от верхнего слоя смолы. При введении новых порций раствора зона обмена смещается вниз. Вытекающий из колонки раствор сначала свободен от ионов Na+ до тех пор, пока зона обмена не достигнет нижней границы слоя ионита, при этом наблюдается «проскок» — ионы Na+ появляются в вытекающем растворе. Емкость смолы до проскока (как и сам «проскок») — не строго определенная величина, так как она зависит от чувствительности метода определения «проскочившего» иона. Для стандартизации величин емкости можно выбрать подходящее значение С/Со, принимаемое за «проскок», например С/Со=0,001. Если продолжать подавать раствор NaCl в верхнюю часть колонки и строить зависимость концентрации ионов Na+ (CNa+) в вытекающем растворе или отношения CNa+/Co от времени или объема вытекающего раствора, получим выходную кривую (рис. 42). Часто по оси абсцисс откладывают общее число ионов (мг-экв) в вытекающем из колонки растворе (в нашем случае Na++H+).
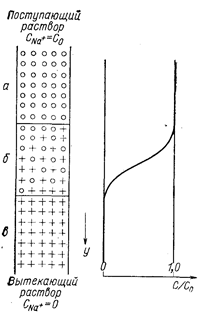
Рис. 41. Схема ионного обмена в колонке (справа - изохрона обмена) (Самуэльсон О., 1966, с. 96, рис. 5.1): а - катионит в Na+ -форме; б - зона обмена; в -катионит В Н+- форме.
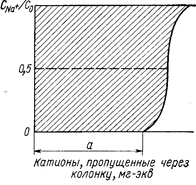
Рис. 42. Выходная кривая при наличии одного сорта способных к обмену ионов в поступающем растворе (Самуэльсон О., 1966, с. 98, рис. 5.2).
Очевидно, что на рис. 42 заштрихованная площадь выражает полную емкость колонки. Для симметричной выходной кривой емкость можно характеризовать также величиной абсциссы в соответствующей точке, в которой С/Со=0,5. Величина абсциссы а равна емкости ионита до проскока при данных условиях. Емкость до проскока зависит от многих факторов (скорости протекания, зернения ионита, емкости ионита).
Если в растворе содержится смесь двух (или более) ионов, способных к обмену, то в колонке может происходить их разделение (из-за разного сродства к иониту). Так как раствор непрерывно протекает через новые слои ионита, а в колонку поступают новые порции раствора, эффект частичного разделения, достигаемый при простом однократном встряхивании ионита с раствором, оказывается как бы многократно повторенным. Рассмотрим процесс пропускания раствора, содержащего ионы Са2+ и NH4+, через колонку в Н+-форме. Вначале происходит количественное поглощение как ионов аммония, так и ионов кальция. Через некоторое время начинается проскок ионов аммония, сродство которых к смоле наименьшее в смеси. Количество ионов аммония в вытекающем растворе растет, затем наступает момент, когда начинается проскок ионов Са2+, после чего состав вытекающего раствора постепенно изменяется до тех пор, пока составы вытекающего и поступающего раствора не станут одинаковыми (рис. 43).
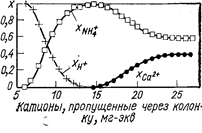
Рис. 43. Выходные кривые при наличии в поступающем растворе двух видов ионов с различной способностью к обмену (Самуэльсон О., 1966, с. 99, рис. 5.3). Катионит сульфофенольный; х - эквивалентные доли ионов водорода, аммония и кальция в растворе.
Так протекает хроматографическое разделение по методу фронтального анализа. При этом получают в чистом виде единственный компонент, обладающий наименьшей способностью поглощаться. В таких разделениях велика роль комплексообразователей (особенно селективных), добавление которых в систему может существенно уменьшать поглощение ионитом некоторых ионов, способствуя тем самым их очистке.
Теоретический расчет выходных кривых или изохрон обмена в настоящее время практически невозможен. Однако определенные оценки можно сделать на основании идеализирующих предположений относительно кинетики ионного обмена. В зоне обмена состояние тем ближе к равновесному, чем ниже скорость протекания раствора через колонку, следовательно, с понижением скорости протекания увеличивается «острота» фронта выходных кривых (рис. 44).
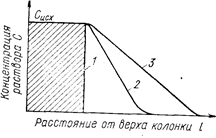
Рис. 44. Острота фронта выходных кривых: 1- идеально острый фронт при больших значениях константы обмена, бесконечно малой скорости протекания раствора и отсутствии продольной диффузии; 2 и 3 - последовательное повышение скорости протекания.
Любой фактор, повышающий скорость обмена (уменьшение зерен смолы, повышение температуры), должен увеличивать остроту фронта. Однако при очень низких скоростях протекания раствора фронт заметно размывается из-за продольной диффузии вдоль колонки. Неравномерность потока жидкости в колонках также влияет на остроту фронта.
Форма выходных кривых сильно зависит от типа изотермы обмена, определяющей статическое равновесие. Показано, что при выпуклых изотермах обмена происходит самозаострение фронта независимо от кинетических закономерностей обмена. Следовательно, если происходит размывание фронта вследствие каких-либо кинетических причин (высокая скорость протекания раствора и пр.), то при дальнейшем движении раствора вниз по. колонке острота фронта восстанавливается. После некоторого времени продвижения раствора изохропа обмена приходит к своей конечной форме, которая с постоянной скоростью перемещается вдоль колонки (в этом случае изохрона и выходная кривая идентичны). В случае линейной и особенно вогнутой изотермы вызванное какими-либо причинами уменьшение остроты изохроны увеличивается при дальнейшем продвижении зоны обмена.
Дата добавления: 2019-04-03; просмотров: 761;
