РАВНОВЕСИЕ ИОННОГО ОБМЕНА
ИОННЫЙ ОБМЕН
Проблема выделения и очистки урана для нужд ядерной энергетики поставила перед наукой и техникой задачу: совершенствовать имеющиеся и создавать новые методы разделения. Одним из таких методов, позволяющих получить достаточно хорошую очистку основного компонента от примесей, является ионообменная хроматография.
Однократный обмен между твердым телом, включающим подвижные ионы, и раствором может служить методом очистки лишь в редких случаях огромной разницы в ионообменном поведении разделяемых элементов. Для разделения ионов с близкими свойствами применяют ионообменную хроматографию. По определению Ф. М. Шемякина, при хроматографировании смеси веществ происходит пространственно различное распределение каждого компонента данной смеси между двумя фазами с последующим полным разделением в пространстве этих компонентов путем промывания, вытеснения или выделения осадка. Причиной такого разделения является различие во взаимодействии каждого из компонентов данной смеси веществ, находящихся в первой фазе, называемой растворителем, со второй фазой, называемой сорбентом.
В технологии редких элементов ионообменная хроматография оказалась особенно полезной при разделении большой группы химически подобных редкоземельных металлов. Лишь ее освоение сделало доступными в значительном количестве индивидуальные лантаноиды, что стимулировало дальнейшее изучение их химии и области применения, а в конечном итоге расширило масштаб их добычи и производства. Можно определить четыре главные области применения ионного обмена в гидрометаллургии: 1) обогащение или концентрирование; 2) разделение; 3) очистка и 4) обезвреживание стоков.
Ионообменными свойствами обладают природные неорганические соединения -цеолиты (алюмосиликаты сложного состава). В начале XX столетия начался синтез искусственных материалов типа цеолитов. Некоторые органические вещества (например, целлюлоза) также обладают свойством обмениваться ионами с раствором. Сульфирование угля придает ему ионообменные свойства. В тридцатых годах нашего столетия началось внедрение в науку и промышленность синтетических органических ионитов. Органические катиониты представляют собой нерастворимые вещества, в состав которых входят прочно связанные с ними кислотные группы (сульфо-, карбоксильные, ОН-группы фенолов, фосфиновые и т. п.). В состав анионитов входят основные группы (например, аминогруппы), которые могут образовать соли при взаимодействии с кислотами. Водородные ионы или ионы металлов катионитов и анионы, входящие в состав анионитов, обмениваются на катионы или анионы раствора.
СИНТЕЗ ИОНИТОВ
Формулу катионита в Na-форме схематично можно изобразить следующим образом:
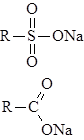 Сульфокатионит
Сульфокатионит
карбоксильный катионит
(R—органический каркас, матрица ионита).
Большинство применяемых в настоящее время ионитов представляют собой сополимеры стирола С6Н5СН=СН2 и дивинил-бензола С6Н4(СН=СН2)2.
Полимеризация чистого стирола приводит к образованию линейного полимера:
 |
Добавка дивинилбензола позволяет получить матрицу с поперечными связями:
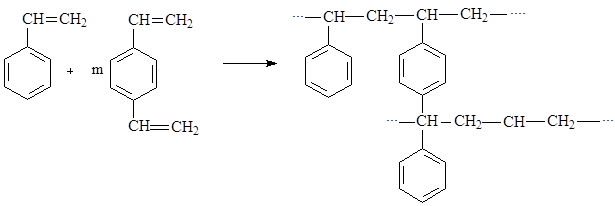 |
Количество дивинилбензола в полимеризуемой массе определяет поперечную связанность (жесткость) смолы, что иногда отражается в маркировке смолы, например: КУ-2х8 означает сульфокатионит КУ-2 с 8% дивинилбензола.
Мостикообразующим агентом в процессах поликонденсации может служить формальдегид:
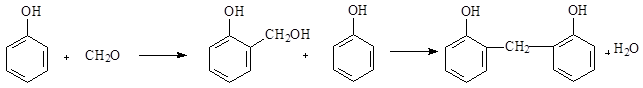
Метиленовые мостики могут возникать между цепями, образуя пространственную сетку.
В настоящее время большое значение приобретают полимеризационные (стирол-дивинилбензольные) смолы, обладающие большой обменной емкостью, химической и механической устойчивостью по сравнению с конденсационными фенол-формальдегидными обменниками.
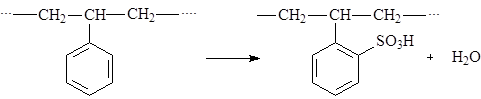 |
Сульфирование производят концентрированной серной кислотой, или хлорсульфоновой кислотой SО2(OH)Cl с последующим гидролизом. При этом происходит сульфирование практически каждого бензольного кольца:
 Использование в производстве сульфокатионитов вместо фенола n-фенолсульфокислоты
Использование в производстве сульфокатионитов вместо фенола n-фенолсульфокислоты
позволяет исключить операцию сульфирования.
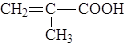 Карбоксильные катиониты можно получить сополимеризацией акриловой CH2=CH—СООН или метакриловой кислоты с дивинилбензолом и др.
Карбоксильные катиониты можно получить сополимеризацией акриловой CH2=CH—СООН или метакриловой кислоты с дивинилбензолом и др.
При этом катионообменник может иметь структуру:
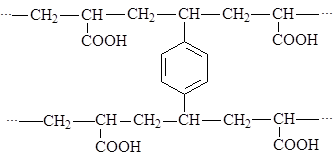 |
Чаще находят применение сополимеры метакриловой кислоты. Большую часть анионитов получают введением обменных групп в тот же полистирол-дивинилбензольный каркас. Прежде всего вводят монохлорметильную группировку
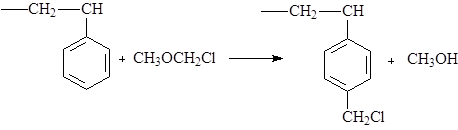 |
Затем производят обработку амином (например, триметиламином), которая (в случае триметиламина) приводит к образованию четвертичного аммониевого основания:
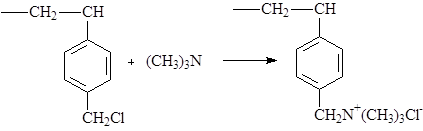 |
В результате получают сильноосновный анионит в Сl-форме. Возможна обработка первичными и вторичными аминами.
Слабоосновные аниониты получают поликонденсацией ароматических аминов. При этом элементарное звено макромолекулы может иметь вид
 |
Возможны и другие схемы синтеза ионообменных смол, в которых используют в качестве исходных различные органические соединения.
Существует целая группа ионитов, обладающих повышенной избирательностью по отношению к ионам определенного вида, - комплексообразующие (хелатные) иониты. Это свойство связано с наличием в ионите дополнительных функциональных групп, образующих с определенными ионами раствора координационную связь:
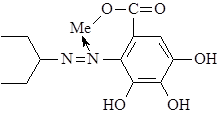 |
Так, диалкилфосфатный ионит оказался селективным по отношению к ионам Ве2+. Селективные хелатные иониты могут быть получены совместной поликонденсацией веществ, содержащих ионообменные группы с комплексообразующими соединениями (например, поликонденсация сульфофенола, этилендиаминтетрауксусной кислоты и формальдегида).
Синтезированы смолы, обладающие восстановительными свойствами. Они могут содержать гидрохинонные группы и способны к «электронообмену». Восстановительными свойствами обладает сульфоуголь.
В особую группу можно выделить неорганические обменники. Многочисленные неорганические ионообменники можно разделить на несколько главных типов: 1) алюмосиликаты; а) с двумерной слоистой структурой (глины, слоистые цеолиты); б) с трехмерной сетчатой структурой (цеолиты); 2) несиликатные соединения (соли гетерополикислот); 3) гидроокиси многовалентных металлов; 4) кислые соли многовалентных металлов и многоосновных кислот.
Интерес к неорганическим обменникам в последние, годы связан с их способностью работать при высокой температуре и под действием ионизирующего излучения. Проведение сорбции в подобных условиях тесно связано с развитием ядерной энергетики.
РАВНОВЕСИЕ ИОННОГО ОБМЕНА
Ионит состоит из углеводородного каркаса - матрицы, обладающей положительным или отрицательным зарядом. Матрицу можно рассматривать как поливалентный ион. Заряд матрицы компенсируется зарядами ионов противоположного знака - противоионами. Противоионы могут заменяться в эквивалентном количестве на другие ионы того же знака. Ионы, имеющие знак заряда, одноименный со знаком заряда матрицы, называются коионами.
В первом приближении можно считать, что переход ионов из раствора в смолу осуществляется лишь путем обмена на эквивалентное количество противоионов смолы. Эквивалентность ионного обмена обусловливает существование предела сорбции - полной обменной емкости (ПОЕ), которая определяется полным зарядом матрицы.
Классификация ионитов чаще всего основывается на отношении их к водородным (или гидроксильным) ионам, на зависимости обменной емкости от кислотности (щелочности) раствора. Такая классификация может служить основой для выбора ионитов, за исключением тех случаев, когда смола обладает резко выраженной специфической способностью поглощать ионы определенного вида. Б. П. Никольский предлагает делить иониты на четыре группы:
I. Иониты, проявляющие свойства сильных кислот или оснований. Катиониты этого типа характеризуются легкостью вытеснения из них ионов водорода другими катионами. Уже при малых значениях рН ионы водорода замещаются на катионы раствора. Аниониты этого типа характеризуются легкостью обмена ионов гидроксила на анионы различных кислот.
Активной группой в катионитах I типа является группа –SO3H. Аниониты этого типа содержат четвертичные аммониевые основания (=N=+). К ионитам I типа относятся КУ-2, КУ-3, КУ-4, СДВ-2, СДВ-3, АР, АВ-16, АВ-17.
II. Иониты, проявляющие свойства слабых кислот или оснований. При низких значениях рН катионы большинства металлов почти неспособны поглощаться катионитами этого типа (ион водорода не вытесняется). Аналогичные свойства проявляют аниониты этого типа по отношению к анионам при низких значениях рОН. При повышении значения рН (или рОН) обменная емкость ионитов этого типа вначале незначительная, затем быстро возрастает. Активные группы ионитов этого типа: -СООН; -SiO3H; -ОН; -NH3+; =NH2+ или = NH+ (силикагель, КБ-4, КБ-4П2, СГ-1, ЭДЭ-10П, АН-2Ф, АН-1, ММГ-1, НО).
III. Иониты смешанного типа, проявляющие свойства смеси сильной и слабой кислот или оснований. Определенная обменная емкость для этих смол реализуется уже при низких значениях рН или рОН (за счет сильнокислотных или сильноосновных групп). При повышении рН или рОН обменная емкость резко возрастает в тот момент, когда начинают «работать» слабоосновные или слабокислотные группы.
Катиониты этой категории содержат различные кислотные остатки (например, карбоксильную и сульфогруппу), аниониты - смесь =N=+ и ºNН+: КУ-1, КУ-6, КБУ-1, СНФ, КФ-1, КФУ, СМ-12, сульфоуголь, ПЭК.
IV. Иониты, обменная способность которых непрерывно возрастает по мере повышения рН или рОН. Такие ионнты ведут себя подобно смеси многих кислот или оснований различной силы. Изменение их обменной емкости происходит постепенно в широком интервале рН (рОН). К ним относятся многие природные ионообменники (почвы, глины и т. п.).
На рис. 39 приведены кривые, характеризующие зависимость обменной емкости ионитов четырех типов от рН (для катионитов) и рОН (для анионитов).
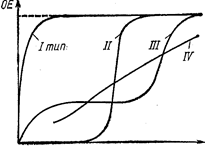
Рис. 39. Кривые, характеризующие иониты четырех типов [зависимость обменной емкости ионита ОЕ от рН раствора (рОН раствора)] (Айвазов Б. В., 1968, с. 78, рис. 24).
Полная емкость, отнесенная к определенному количеству смолы, есть величина постоянная. Обычно емкость относят к единице массы или объема набухшего или сухого ионита. За стандартизованное состояние при определении емкости обычно принимают катионит в Н+-форме и анионит в С1--форме. Емкость часто приводят в миллиграмм - эквивалентах сорбируемого вещества на грамм смолы в стандартном состоянии, отмытой от избытка адсорбированных веществ и высушенной.
Ёмкость обычных ионитов составляет в среднем 3-5 мг-экв/г. Полную емкость сильноосновных и сильнокислотных ионитов можно определить потенциометрическим титрованием щелочью катионита в Н+-форме или кислотой анионита в ОН--форме. Существует много других способов определения полной обменной емкости, например по установлению концентрации –SO3H по сере в сульфокатионите.
Функциональные группы ионита гидрофильны, поэтому при погружении ионита в раствор вода проникает в ионит, и он набухает, но из-за наличия поперечных связей не растворяется. Набухание ионита зависит от числа гидратации поглощаемых ионов, числа и характера ионообменных групп, гидратации сорбируемых ионов, и с уменьшением степени поперечной связанности (уменьшением процента дивинилбензола в смоле) набухание ионита увеличивается. Объем большинства набухших ионитов 2-3 мл на 1 г сухого ионита.
Если ионит, полностью насыщенный ионами А, приводится в равновесие с раствором, содержащим ионы В, часть ионов А замещается ионами В - устанавливается ионообменное равновесие, описываемое уравнением
RAс + Bв+ « RBс + Aв+,
где обменивающиеся ионы для простоты полагаются одновалентными, а индексы «с» и «в» относятся к фазе смолы и раствора соответственно.
Для качественного описания распределения данного иона между двумя фазами можно использовать коэффициент распределения, равный отношению концентрации иона в ионите к его концентрации в растворе: Da = [Св]с/[Св]в, где [Св] - концентрация иона В. Величина Da зависит от способа выражения концентрации.
Преимущественное поглощение одного из ионов называется селективностью (избирательностью) ионита. Селективность можно охарактеризовать коэффициентом разделения:
Sb,A B = Da,B/Da,A = ([CВ]c/[CВ]в) : ([CА]c/[CА]в) = ([CВ]c.[CА]в) / ([CВ]в.[CА]с)
В литературе этот коэффициент часто называют коэффициентом избирательности. Выражение для коэффициента избирательности при обмене равновалентных ионов совпадает с выражением для кажущейся константы реакции ионного обмена (КАВ). Для обмена разновалентных ионов
КАВ = ([CВ]cnA.[CА]вnB) / ([CВ]вnA.[CА]сnB) = Da,BnA / Da,AnB
где n - заряд обменивающегося иона.
Концентрация обменивающихся ионов в растворе выражается обычно в единицах молярности или моляльности. В фазе ионита концентрация может выражаться в миллиграмм-эквивалентах на грамм сухой смолы («моляльность»). Удобно, выражать концентрацию в обеих фазах в виде эквивалентной доли какого-либо противоиона:
[NA]c = nA[CА]с / (nA[CА]с + nB[CB]с)
[NA]в = nA[CА]в / (nA[CА]в + nB[CB]в)
или в общем виде
[Nj] = njCj / åniCi
i
где С - любое, но одинаковое для всех ионов выражение концентрации в данной фазе. Если коэффициенты активности можно принять равными 1 или постоянными, график в координатах {[CВ]вnA / [CА]вnB}c - {[CВ]вnA / [CА]вnB}в будет представлять собой прямую с тангенсом угла наклона КАВ. При обмене равновалентных ионов значение КАВ служит количественной характеристикой избирательности ионита: если КАВ >1, ион В обладает большим сродством к смоле; КАВ =1 - сродство ионов одинаково; КАВ <1 - ион А сорбируется предпочтительнее. Для разновалентных ионов при выражении их концентрации в обеих фазах в ионных долях (Ni) величины КАВ и Sb,A B будут равны 1 в одних и тех же условиях, и равенство КАВ =1 так же, как и для равновалентных ионов, является границей лучшего сродства обменивающихся ионов.
Изображение изотермы обмена в координатах ионных долей часто принято в практике описания систем. При этом по сторонам квадрата откладывают эквивалентные доли иона данного вида в фазе раствора Nв (абсцисса) и в фазе смолы Nc (ордината). Существуют изотермы трех основных видов: выпуклая (благоприятная, говорящая о преимущественной сорбции данного иона), линейная (безразличная, сродство равно) и вогнутая (неблагоприятная) (рис. 40). Иногда встречаются изотермы, имеющие точку перегиба из-за изменений селективности ионита при изменении состава раствора.
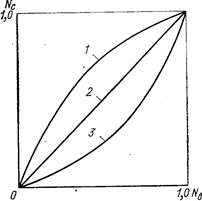
Рис. 40. Изотермы обмена различного типа (Самуэльсон О., 1966, с. 101, рис. 5.5):
1 - выпуклая (благоприятная) изотерма; 2 - линейная изотерма: 3 - вогнутая (неблагоприятная) изотерма (Nc, Nв - эквивалентные доли иона в фазе ионита и раствора).
Как показывает опыт, постоянство значения КАВ сохраняется не во всех случаях и лишь для разбавленных растворов. КАВ практически никогда не остается постоянной для растворов с концентрацией более 0,1 н. Необходимо в выражении для константы использовать не аналитические концентрации ионов, а их активности в растворе и смоле. При переходе к величинам активности возникают трудности. Средние коэффициенты активности для растворов чистых солей определены различными способами и многие табулированы. Однако данные, относящиеся к смесям даже простейших электролитов, в литературе крайне скудны. Известные уравнения для вычисления коэффициентов активности Дебая- Гюккеля:
-lgg± = n+ n-AÖm, (27)
где g± - коэффициент активности; n -заряд; A - константа; m - ионная сила; и с учетом поправки на размер ионов:
-lgg± = [n+ n-AÖm] / [1 + a0BÖm], (27)
(a0 - расстояние наибольшего сближения ионов, В - константа), а также другие, более сложные уравнения чаще всего справедливы для сравнительно разбавленных растворов или содержат трудноопределимые величины. Правило ионной силы показывает, что коэффициент активности одного иона в смеси электролитов -lggi = An+2Öm зависит (в пределах применимости формулы) лишь от его заряда и ионной силы. Следовательно, коэффициенты активности ионов, обладающих равным зарядом, равны и не зависят от их отношения в растворе (случай, реализующийся в ионном обмене в условиях эквивалентного обмена равнозарядных ионов). Для ионов разного заряда отношение коэффициентов активности постоянно. Правило ионной силы, однако, практически неприменимо для растворов с m>0,1. Существуют методы, позволяющие определить активность соли в смеси электролитов, но в каждом случае это трудоемкая работа.
Еще более сложна проблема определения коэффициентов активности ионов в смоле. Ионообменник можно рассматривать как гомогенный высококонцентрированный электролит. Если не обращать внимания на тот факт, что вода (растворитель), поглощенная ионообменником, частично связана (сольватирует) с неподвижно связанными с матрицей анионными группами катионообменника (которые ввиду своей неподвижности осмотически неактивны), то простой расчет показывает: для сульфо-кислотной смолы средней степени сшивки, имеющей емкость 5 мг-экв/г, в набухшем состоянии на один способный к обмену катион приходится 9-10 молекул воды. Для сильносшитых смол количество воды вдвое меньше. Это соответствует концентрации электролита во «внутреннем» растворе 6 н. и выше. Высокая электропроводность смол в набухшем состоянии подтверждает правильность такого представления о состоянии сорбирован-ного иона. Осложняющими обстоятельствами (по сравнению с обычным концентрированным раствором) являются: трудность учета электростатического взаимодействия с неподвижными ионами матрицы; определенная «неподвижность» части воды (растворителя), идущей на сольватацию неподвижных ионов матрицы, что ведет к трудно учитываемому повышению концентрации обменивающихся противоионов в фазе смолы.
Кажущаяся константа ионного обмена связана с термодинамическими параметрами системы уравнением
lnKAB = ln(gAnB/gВnA)c + ln(gВnА/gAnВ)в - Р(nAuB0 - nBuA0)/RT (28)
где g - коэффициент активности; Р - давление набухания; u0 - парциальный молярный объем. Поскольку KAB связана с коэффициентом избирательности, приведенное уравнение позволяет качественно оценить влияние различных факторов на избирательность.
Давление набухания зависит от степени сшивки смолы. В самом деле, если мы рассмотрим смолу (катионит) как полупроницаемую перегородку (за полупроницаемую перегородку принимают поверхность зерна ионита, проницаемую для молекул растворителя и катионов, но непроницаемую для фиксированных ионов, для анионов), то осмотическое давление со стороны внешнего раствора всегда превышает осмотическое давление со стороны раствора в фазе ионита по нескольким причинам. Во-первых, в фазе ионита всегда «раствор» высокой концентрации (6 н и выше). Во-вторых, фиксированные ионные группы, определяющие емкость смолы, осмотически неактивны. В-третьих, матрица (каркас) смолы для уравновешивания внешнего осмотического давления оказывает на раствор в фазе смолы давление, обусловленное упругостью каркаса. Набухание смолы с большим процентом сшивки мало, концентрация «внутреннего» (при равной емкости) раствора выше, следовательно, и давление Р, оказываемое каркасом смолы на «внутренний» раствор, выше. Как видно из приведенного уравнения, повышение количества сшивок должно привести к увеличению избирательности. Чем больше разница объемов гидратированных ионов (uA0 - uB0), тем выше избирательность.
Для ионов с небольшой разницей объемов решающее значение приобретает соотношение коэффициентов активности. Как было сказано выше, соотношение коэффициентов активности во внешнем растворе мало влияет на коэффициент избирательности. Однако такое явление в растворе, как. меньшая диссоциация соли AY по сравнению с BY (и, как следствие, уменьшение gA,в по сравнению с gВ,в), должно благоприятно сказываться на избирательности.
Сюда же следует отнести влияние комплексообразования в растворе, имеющее большое значение в процессе ионообменного разделения РЗЭ, Zr и Hf и т. д.
Большое значение имеет член (gA/gВ)с. Например, для слабокислотных смол, насыщенных ионами металла (А), присутствие во внешнем растворе даже небольшого количества водородных ионов сдвигает реакцию в сторону десорбции металла, так как активность водородных ионов в фазе смолы (gВ) - величина чрезвычайно малая (слабая диссоциация смолы в Н+-форме), gВ << gA,
gА/gВ >> 1, ln (gА/gВ)c >> 1
что приводит к увеличению lnKAB, т. е. к десорбции металла в описываемых условиях. Этим объясняется влияние рН при обмене на слабокислотных или слабоосновных ионитах.
Естественно, что увеличение валентности иона должно приводить к большей прочности связи иона с матрицей смолы (образование ионных пар и т. п.), что уменьшает коэффициент активности, данного иона в смоле и способствует сдвигу равновесия в сторону сорбции многовалентного иона.
Обычно изменение температуры слабо влияет на равновесие ионного обмена. В большинстве изученных систем, содержащих ионы с равными зарядами, рост температуры приводит к ухудшению избирательности, а в системах, содержащих ионы с различным числом зарядов, — к улучшению. Однако известны исключения. Изменение избирательности с изменением температуры связано, видимо, с различием в температурных зависимостях коэффициентов активности обменивающихся ионов.
Таким образом, возможно качественно оценить обменное равновесие. Однако количественная оценка затруднена из-за отсутствия необходимых данных. Нет точных сведений о давлении набухания, которое может составлять около 250 ат для обмена К—Li на сульфокислотной смоле с 12% дивинилбензола. Иногда это давление достигает 1000 ат, что необходимо принимать во внимание при конструировании ионообменной аппаратуры: плотная набивка колонок смолой может привести к их разрыву при изменении набухания.
Отсутствуют данные об объемах, занимаемых гидратированными ионами в смоле. Осложнения вносятся также адсорбцией нейтральных солей. Если представить себе катионит, насыщенный противоионами А, приведенный в контакт с раствором соли АХ, то концентрация противоиона А всегда больше в катионите (противоионы А стремятся диффундировать в раствор, но это нарушает электронейтральность системы, ионит заряжается). Напротив, коионы Х (в первом приближении) вообще не присутствуют во внутреннем растворе ионита. Если бы ионы не несли зарядов, их концентрации (активности) стремились бы выравняться путем диффузии. Однако это нарушало бы электронейтральность смолы и раствора. При переходе ничтожных количеств противоиона в раствор, а коиона в ионит возникает электрический потенциал между смолой и раствором, который препятствует дальнейшему диффузионному переходу. Возникающий потенциал называется доннановским. Легко подсчитать, что для заряда 1 л раствора до потенциала 300 в необходимо поместить в раствор ~2.10-14 г-экв ионов одного знака. Однако при высокой концентрации внешнего раствора катионит может дополнительно сорбировать анионы, которые увлекают за собой эквивалентное количество катионов, в результате наблюдается адсорбция нейтральной соли. Для обычных ионообменников адсорбция нейтральной соли становится заметной лишь при концентрации внешнего раствора выше 0,1 н, но затем очень резко возрастает.
Дальнейшее развитие теория селективности получила в работах Эйземана—Линга, которые в качестве характеристики гидратации использовали не радиусы или объемы гидратированных ионов, а четко определенные энергетические величины и электростатическое взаимодействие рассматривали как непосредственную причину обращения сродства. Выводы теории Эйземана-Линга подробно описаны в сборнике «Ионный обмен» (Пер. с англ. Под ред. Я. Марийского. М., «Мир», 1968, с. 138-144).
Кроме понятия избирательности ионообменников существует понятие специфичности. Специфичность ионообменного поглощения определяется индивидуальными свойствами обменивающихся ионов и ионообменников. Примером специфичности может служить избирательное поглощение ионов щелочноземельных металлов сульфокатионитами. При этом прочность связи катионов со смолой убывает в ряду Ba>Sr>Ca>Mg. В этом же ряду возрастает растворимость соответствующих сульфатов. Иногда специфичность определяется структурным родством поглощаемых ионов со скелетом обменника (например, при поглощении фенильных остатков). Интересным случаем специфичности является сорбция хелатными смолами, которые содержат группы, способные образовывать хелатоподобные комплексы с ионами металлов.
Сюда же относятся способы повышения избирательности, носящие физический характер, например использование молекулярных сит, т. е. применение ионообменников, имеющих определенный размер пор. При этом крупные ионы не сорбируются.
Часто свойства ионитов объясняются на основании представлений о доннановском равновесии. По теории Доннана, ионит рассматривают как мембрану, разделяющую два раствора (внешний и внутренний) и непроницаемую по крайней мере для одного вида ионов одного из растворов. Внутренний раствор обычно более концентрированный. Обмен ионов между двумя растворами происходит до установления мембранного равновесия. Термодинамическим условием равновесия является равенство произведений концентрации катионов и анионов по обе стороны мембраны. Так, для диффузии NaCI через мембрану условием равновесия будет [Na1+] [Cl2-] = [Na2+] [Cl1-], где индексы 1 и 2 относятся к растворам по обе стороны мембраны. Однако в присутствии аниона А- функциональной группы, неспособного к диффузии через мембрану, концентрация NaCl по обе стороны мембраны различается и меньше там, где присутствуют осмотически неактивные анионы матрицы. Поверхность зерна ионита можно рассматривать как мембрану, непроницаемую для функциональных групп ионитов, закрепеленных на каркасе.
Некоторые свойства ионообменников в настоящее время пока трудно объяснить. Одно из таких явлений—необратимость избирательности: если для данного обменника известны константы обмена для двух пар ионов с общим ионом К12 и К13, то не всегда можно рассчитать величину К23 как отношение К13/ К12 .
Делаются попытки описывать ионообменные равновесия полуэмпирическими формулами, например
(C11/n1 / C21/n2)c = K(C11/n1 / C21/n2)1/A
где n1 и n2 - валентность ионов; С - концентрация; К и А - константы.
Характеристики важнейших катионитов и анионитов отечественного производства и иностранных марок представлены в табл. 22.
Таблица 22
Характеристики важнейших катионитов и анионитов отечественных и иностранных марок
| Ионит | Краткая характеристика |
| Отечественные марки Катионит КУ-1 (эспатит-1) | Сильнокислотный, бифункциональный (содержит сульфогруппу и фенольный гидроксил), конденсационного типа. Получается при конденсации фенолсульфокислоты и формальдегида. Механически прочен, стоек к органическим растворителям, кислотам. Нестоек к щелочам и окислителям. Н-форма катионита способна к ионному обмену только в сильнощелочной среде. Черные зерна размером 0,3-2 мм. Применяется также в Nа+-форме |
| Сульфоуголь | Катионит, сильнокислотный, полифункциональный. Содержит сульфогруппы, карбоксильные и ОН-группы. Получают сульфи-рованием олеумом бурых углей или каменного угля. Черные зерна размером 0,25-1 мм, неправильной формы. Применяют в Н- и Na-формах. Химически малоустойчив, разрушается щелочами и окислителями. Является восстановителем для солей Fe, Cr, Mo. Eo =0,2-3 в. Устойчив до 30-60° С |
| Катионит КУ-2 | По свойствам близок к амберлиту IR-120, дауэкс-50. Сильнокислотный, монофункциональный (содержит сульфогруппы). Получают при сульфировании сополимера стирола и дивинилбензола. Стоек к кислотам и щелочам, органическим растворителям и окислителям. Можно работать до 100° С. Желтоватые полупрозрачные зерна размером 0,4 мм. Применяется в Н+- и Na+-формах. Мало изменяется в интервале рН от 3 до 13 |
| Катионит СБС | Сильнокислотный, монофункциональный, полимеризационного типа, содержит сульфогруппы. Получается сульфированием олеумом сополимеров стирола или бутадиена. Черные зерна неправильной формы размером 0,3-1,5 мм. Применяется в Н+- и Na+-формах. Зерна механически прочны, устойчивы к кислотам, щелочам и окислителям |
| Катионит КБ-1 | Слабокислотный, монофункциональный (содержит карбоксильную группу), полимеризационного типа. Сополимер метакриловой кислоты и дивинилбензола. Стоек химически даже при длительном нагревании со щелочами при 200° С. Белые полупрозрачные. шарики размером 0,3-0,8 мм. Применяется в Н+- и Na+-формах. Статическая емкость сильно зависит от рН |
| Катионит КБ-2 | Слабокислотный, монофункциональный (содержит карбоксильную группу), полимеризационного типа. Сополимер метилового эфира акриловой кислоты с дивинилбензолом. Последующее омыление эфирных групп. Белые желтоватые шарики размером 0,3-1 мм |
| Катионит СГ-1 | Слабокислотный, монофункциональный (содержит карбоксильную группу), полимеризационного типа. Белые и желтоватые зерна размером 0,8-2 мм. Устойчив к кислотам и органическим растворителям. В щелочах сильно набухает. Механически прочен |
| Анионит АВ-17 | Сильноосновный, монофункциональный (содержит группы - N(СН3)3+), полимеризационного типа. Получают аминированием хлорметилированного сополимера стирола и дивинилбензола. Желтые полупрозрачные зерна размером 0,4-1,2 мм. В ОН--форме обменная емкость по сульфату натрия остается постоянной в широком интервале рН. В ОН--форме очень гигроскопичен. Стоек к кислотам, щелочам и окислителям. Механически прочен |
| Анионит АВ-16 | Сильноосновный, полифункциональный (содержит вторичные и третичные аминогруппы с заместителями алифатического ряда и частично пиридиновые группы). Получают поликонденсацией пиридина, полиэтилена, полиаминов и эпихлоргидрина. Темно-коричневые зерна размером 0,4-2 мм. Емкость сильно зависит от рН. Механически мало прочен, зерна растрескиваются, поэтому их предварительно замачивают в растворе хлорида натрия |
| Анионит ЭДЭ-10П | Слабоосновный, полифункциональный (содержит вторичные и третичные аминогруппы и четвертичные аммониевые группы). Функционирует как среднеосновный и даже сильноосновный. Получают поликонденсацией полиэтиленполиаминов с эпихлор-гидрином. Светло-коричневые полупрозрачные зерна размером 0,4-1,7 мм. Устойчив к кислотам и щелочам. Окислители разрушают анионит. В солевой форме гидролизуется водой. Зерна механически прочны. Устойчив до 60° С |
| Анионит АН-2Ф | Слабоосновный, полифункциональный (содержит вторичные и третичные аминогруппы). Получают поликонденсацией метилольных производных полиэтиленполиаминов с фенолом в кислой среде. Красновато-коричневые зерна размером 0,3-2 мм. Кремневую кислоту не поглощает. Зерна механически прочные. Устойчив к кислотам, щелочам, окислителям. Близок к амберлиту IR-4B. Устойчив до 40° С |
| Анионит АН-1 (эспатит ТМ) | Слабоосновный, полифункциональный (содержит первичные и вторичные аминогруппы и триазиновые кольца). Получают поликонденсацией триметилолмеламина в сернокислой среде. Непрозрачные белые зерна размером 0,3-2 мм. Солевые формы легко гидролизуются. Механически прочен. Устойчив до 40оС. Устойчив в разбавленных кислотах и щелочах |
| Важнейшие иностранные марки Амберлит IR-120 Дауэкс-50 | Катионит, сильнокислотный, с высокой емкостью. Химически устойчив. Изготовлен из полистирена. Содержит сульфогруппы. Применяют в Na+ - форме Катионит, стиролдивинилбензольныи полимер, монофункциональный сульфокатионит. Устойчив к кислотам, щелочам и окислителям. Применяют в широком интервале рН. Общая емкость в Н+-форме 5 мг-экв на 1 г сухого адсорбента и 1,9 мг-экв на 1 мл набухшего. Поглощает до 45% воды на единицу массы. Выпускается с различным содержанием ДВБ: от 1 до 16% |
| Амберлит IRC-50 | Катионит, слабокислотный, полимеризационного типа. При рН=7 обменная емкость 8 мг-зкв/г. Монофункциональный, карбоксильный. Стоек к кислотам, щелочам, органическим растворителям, окислителям и восстановителям. |
| Амберлит IRA-400 | Анионит, сильноосновный, монофункциональный. Полимеризационная смола из полистирена с четвертичными аммониевыми группами. Применяют в Сl--форме. Содержит 8% ДВБ. Устойчив химически |
| Амберлит IR-4B | Анионит, слабоосновный, фенолформальдегидного типа. Применяют при рН от 0 до 7. Устойчив только до 30° С. Неустойчив к окислителям и восстановителям |
| Дауэкс-1 | Анионит, сильноосновный, сополимер стиролдивинилбензоль-ный, содержит четвертичные аммониевые группы. Очень химически стоек и термостоек. Выпускается с 1-10 % ДВБ |
| Цеокарб N-1 | Сульфоуголь. Применяют при рН от 1 до 8. Чувствителен к окислителям. Устойчив да 30° С |
| Цеокарб-225 | Сульфокатионит полистирольного типа. Аналогичен амберлиту IR-120 и дауэкс-50. Применяют при рН от 0 до 14. Устойчив до 100° С и ко всем реагентам |
| Цеокарб-226 | Содержит карбоксильные группы. Применяют при рН от 5 до 14. Устойчив до 100° С и ко всем реагентам. Аналог амберлита IRC-50 |
| Вофатит KS | Катионит, полифункциональный, содержит сульфогруппы и оксигруппы, получают из бензальдегидсульфоновой кислоты, фенола, резорцина и формальдегида |
| Вофатит С | Катионит, слабокислотный, полнфункциональный, получают поликонденсацией из резорциновой кислоты и формальдегида. Полная обменная емкость 7 мг-экв/г. Содержит карбоксильные и оксигруппы |
| Вофатит Р | Катионит, бифункциональный, получают из фенола и формальдегида. Содержит группы –CH2SO3H и гидроксильные группы. Конденсационного типа. Устойчив до 100° С |
| Вофатит D | Близок к вофатиту Р, но получают из фенола, крезола и формальдегида. Емкость 3,2 мг-зкв/г |
| Вофатит F | Сульфокислотный кагионит, конденсационного типа. Получают из фенола и формальдегида. Содержит сульфо- и оксигруппы. Емкость 2,5 мг-экв/г |
| Вофатит М | Анионит слабоосновныи. Г!оликонденгационного типа. Получают из метафенилендиамина, формальдегида, полиэтиленполиаминов. Содержит функциональные группы: трехвалентный азот ºN и иминогруппу =NH. Полная обменная емкость 7 мг-экв/г |
| Вофатит Т | Специально приготовленный синтетический силикат, зерна которого покрыты слоем гидроокиси алюминия. Применяет для удаления из воды кремневой кислоты. Только по названию сходен с органическими ионитами |
Дата добавления: 2019-04-03; просмотров: 1537;
