ЭЛЮИРОВАНИЕ И РЕГЕНЕРАЦИЯ
Под элюированием понимается промывка смолы, обеспечивающая перевод сорбированных ионов в раствор. Когда разделение ионов осуществляется на стадии поглощения (например, при разделении анионов и катионов), смысл элюирования состоит в регенерации смолы, т. е. в вытеснении сорбированных ионов и переводе в исходное состояние. В этом случае для элюирования применяют раствор, содержащий тот же ион, который был адсорбирован на смоле до обмена.
Если ионитом поглощена смесь ионов, то на стадии элюирования можно добиться их разделения. Рассмотрим для примера разделение ионов Na+ и Li+. Анализируемый раствор вводят в колонку, содержащую большой избыток сульфокатионита в Н+-форме. Ионы Li+ и Na+ поглощаются в верхней части колонки. Выделяющуюся при этом кислоту можно удалить промыванием водой. Затем проводят элюирование ионов, пропуская через колонку разбавленную НСl (например, 0,2-0,6 М}. Когда в колонку вводится первая порция кислоты, ионы Li+ и Na+ частично вытесняются из катионита и перемещаются вместе с раствором вниз. Затем в соприкосновение с верхним слоем катионита приходит новая порция кислоты, и вытеснение продолжается. В это время первая порция раствора вступает в контакт с новым слоем катионита, что приводит к новым изменениям в составе раствора и ионита. Ионы Na+ обладают большим сродством к сульфокатиониту, чем Li+. Поэтому ионы Na+ как бы отстают в продвижении по колонке, относительные концентрации ионов Na+ и Li+ изменяются до тех пор, пока (при достаточной длине колонки и достаточном количестве ионита) не образуются отдельные полосы, движущиеся вниз с различными скоростями. Поэтому ионы Li+ обнаруживаются в элюате в течение некоторого интервала времени t1, а ионы натрия - в течение последующего интервала времени t2.
Когда способные к обмену ионы элюента (Н+) имеют меньшее сродство к иониту, чем разделяемые ионы (Na+ и Li+), в элюате в течение всего процесса элюирования обнаруживаются ионы элюента (Н+). Поэтому важно выбирать элюент так, чтобы его ионы легко отделялись от разделяемых ионов. В этом особенность элюентной хроматографии - когда все разделяемые ионы можно в принципе получить в виде отдельных фракций (в отличие от метода фронтального анализа). Однако полосы некоторых элементов могут быть сильно размытыми, и чистыми такие элементы можно получить лишь в виде очень разбавленного раствора. В этом случае полезно применять ступенчатое элюирование. Так как наибольшее «размазывание» наблюдается для наиболее сорбируемых ионов смеси, сначала элюируют несколько ионов одним элюентом, а затем завершают элюирование другим раствором, более эффективно выделяющим ионы, оставшиеся в колонке. Можно применять непрерывное повышение концентрации элюента (градиентное элюирование).
Особая разновидность элюентного анализа - селективное элюирование: когда специфические вещества в элюенте образуют устойчивые, не способные к обмену комплексы с одним или несколькими компонентами разделяемой смеси. Описанный метод элюентного разделения часто называют «проявительным».
Другой разновидностью элюентного разделения является вытеснительная хроматография - когда в состав элюента входит «ион-проявитель», имеющий более высокое сродство к иониту, чем любой из разделяемых ионов. Под действием иона-проявителя все остальные ионы движутся перед ним. Разделяемые ионы, в свою очередь, вытесняют друг друга и разделяются на полосы. После достижения стационарного состояния полосы перемещаются по колонке с постоянной скоростью. Однако практически всегда края полос перекрываются и образуют зоны, где присутствует смесь ионов. Если стационарное состояние уже достигнуто, то увеличение длины колонки не приводит к улучшению разделения (рис. 45).
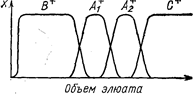
Рис. 45. Вытеснительная хроматограграфия. Разделение двух сортов ионов А1+ и А2+ на катионите в В-форме при помощи «проявителя», содержащего ионы С+. Сродство к катиону C+>A2+>A1+>B+ (Самуэльсон О., 1966, с. 110, рис. 5.15)
Ширина полосы в принципе пропорциональна количеству вещества в ней. Вытеснительная хроматография позволяет за одну операцию получить гораздо большее количество вещества, чем элюентная, так как можно использовать колонки со степенью заполнения смолы разделяемой смесью на 50%. При этом разделяемые вещества получают в виде довольно концентрированных растворов. Во избежание перекрывания зон в разделяемую смесь добавляют иногда легко отделяемый и имеющий промежуточное сродство к иониту ион (так называемая вытеснительная хроматография с носителем).
На вид кривой элюирования влияет вид изотермы (как и на вид выходной кривой). При выпуклой (благоприятной) изотерме обмена передний фронт кривых элюирования должен быть самозаостряющимся, а задний – растянутым. При разделении малых количеств (изотерма линейна), в проявительной хроматографии должны получаться симметричные кривые, а в вытеснительной все границы полос должны быть самозаостряющимися.
На процесс элюирования влияют различные факторы. Так, необходимый для элюирования объем кислоты возрастает с увеличением размера зерна ионита. Показано также, что эффективность элюирования определяется не скоростью протекания и не объемом использованной кислоты, а временем контакта. Поэтому бесполезно пытаться ускорить процесс элюирования, повышая скорость протекания сверх некоторого оптимального значения.
В тех случаях, когда разделению подлежат ионы, сродство которых к смоле различается значительно, элюирование производится раствором кислоты. Установлено, что минимальный расход элюента достигается при некоторой оптимальной концентрации кислоты. При высоких скоростях протекания оптимум выражен более четко. С повышением концентрации кислоты скорость элюирования возрастает вследствие смещения ионообменного равновесия. С другой стороны, высокая концентрация кислоты вызывает усадку ионита. что ведет к уменьшению коэффициентов диффузии ионов в матрице ионита и снижает скорость элюирования. Так же действует и увеличение вязкости раствора с ростом концентрации кислоты.
В расчете ионообменных колонок в настоящее время часто применяют «тарелочную» теорию, которая основана на представлении, что колонка состоит из большого числа отдельных слоев, называемых теоретическими тарелками. Концентрация вещества в обеих фазах в таких слоях принимается постоянной.
Для упрощения часто приходится полагать, что изотермы обмена линейны и что степень зарядки колонки мала (лишь малая часть колонки занята растворенными веществами, подлежащими разделению).
В «тарелочной» теории принимают, что кривые элюирования имеют колоколообразную форму и точки максимума (пики) перемещаются вниз по колонке с постоянной скоростью, пропорциональной отношению f/Сэл, (f - количество растворенного вещества, находящееся в 1 см3 объема колонки в условиях равновесия между раствором и ионитом, мг-экв/см3; Сэл - концентрация вещества в элюате, мг-экв/см3).
При наличии нескольких растворенных веществ они движутся вниз по колонке независимо друг от друга, если только их количества достаточно малы. Кривая элюирования для каждого растворенного вещества подобна по форме гауссовой кривой. Окончательная форма кривой элюирования устанавливается не сразу, а лишь после прохождения зоной вытеснения данного вещества 20-25 теоретических тарелок от нижнего конца зоны загрузки.
Процесс расчета выходных кривых элюирования достаточно подробно описан в книгах О. Самуэльсона «Ионообменные разделения в аналитической химии», Р. Гриссбаха «Теория и практика ионного обмена».
Степень чистоты разделяемых веществ вычисляют из перекрывания полос элюирования. Если элюат состоит из двух фракций, соответствующих двум полосам элюирования (рис. 46), то содержание примеси второго вещества в первой фракции элюата определяется отношением Dm2/m1, где m1, m2 - количества растворенных веществ, введенных в колонку, мг-экв. Составлены диаграммы, изображающие зависимость взаимной загрязненности двух фракций элюата от числа теоретических тарелок.
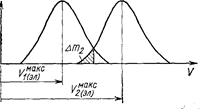
Рис. 46. Перекрывание кривых элюирования (Самуэльсон О., 1966, с. 124, рис. 6.3)
Следует отметить два важных правила, вытекающих из тарелочной теории: а) высота максимума кривой элюирования обратно пропорциональна квадратному корню из длины колонки; б) ширина кривой элюирования прямо пропорциональна квадратному корню из длины колонки.
Вычисления, проделанные с применением тарелочной теории, позволяют правильно выбирать условия разделения, не производя большого числа экспериментов. Следует, однако, отметить, что этот метод вычислений приближенный, так как допущения, лежащие в основе теории, обычно не полностью соответствуют действительности.
На колонке с равномерным заполнением при очень малой скорости протекания высота теоретической тарелки приблизительно равна диаметру зерна ионита. На практике из-за неравномерности потока жидкости внутри колонки hпр > hид. В технологии редких элементов ионный обмен используют не только для разделения, но также и для выделения их из растворов после вскрытия (осветленных и из пульп), для очистки сбросных вод. При этом колонка используется до проскока, после чего исходный раствор переключается на другую колонку, а первая регенерируется. Время работы колонки до проскока называется временем защитного действия. Для времени защитного действия слоя смолы длиной l Н. А. Шилов предложил формулу
t = kl -to,
где k – константа - коэффициент защитного действия; to - потеря времени защитного действия, обусловленного формированием фронта.
При бесконечно большой скорости обмена проскок вещества в последующие слои сорбента происходил бы только после полного насыщения предыдущих. Однако ввиду конечной скорости массопередачи распределение извлекаемого вещества по высоте слоя происходит плавно, с образованием фронта адсорбции (рис. 47). На рисунке приведены кривые распределения относительной концентрации (С/Со) поглощаемого иона по длине / неподвижного слоя ионита (t1 <t2 <t3 <...<ti, где ti - время, прошедшее от начала процесса). Согласно опытным данным, по истечении определенного времени профиль фронта обмена становится практически неизменным. После этого он переносится по направлению потока с постоянной скоростью w. Очевидно, что k=l/w. Скорость w можно найти аналитическим путем:
w = wo . [Co/ (wCo + Cк*)](38)
где wo - скорость протекания раствора над слоем смолы; w - пористость смолы; Со -концентрация иона в питающем растворе; Cк* - концентрация иона в слое ионита, равновесная с концентрацией Со.
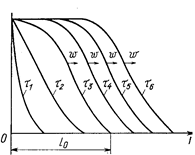
Рис. 47. Изменение фронта адсорбции во времени (Касаткин А. Г., 1971 с. 600, рис. XIV-2).
Для расчета w, таким образом, необходимо предварительно построить изотерму обмена. Зависимость времени защитного действия от длины слоя l в период формирования фронта выражается плавной кривой, которая затем переходит в прямую линию (рис. 48). Построение подобных графиков дает возможность опытным путем определить k = tga и время защитного действия слоя. Естественно, что в опытах по определению tga должны соблюдаться те же гидродинамические условия, что и в проектируемой промышленной колонке.
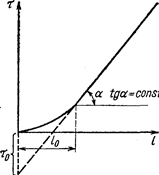
Рис. 48. Зависимость времени защитного действия от длины слоя поглотителя (Касаткин А. Г., 1971, с. 601, рис. XIV-3).
При ориентировочных расчетах количества смолы можно принять емкость до проскока 0,5-0,6 полной емкости для сильнокислотного или сильноосновного ионита и 0,8-0,9 полной емкости для слабокислотной или слабоосновной смолы.
Дата добавления: 2019-04-03; просмотров: 1685;
