Тугоплавкие металлы
Все тугоплавкие металлы (за исключением бериллия) являются переходными элементами. Им свойственны образование катионов нескольких валентностей, высокая стойкость в компактном состоянии и высокая химическая активность в тон-кодисперсном состоянии или при повышении температуры. При нагревании большинство из них активно реагируют с кислородом, азотом и водородом.
К группе тугоплавких относятся (в скобках указана температура плавления металлов, °К): Be (1558°); Sc (1811°); Y (1782°); Ti (1941°); Zr (2125°); Hf (2495°); V (2173°); Mb (2741°); Та (3269°); Cr (2148°); Мо (2883°); W (3683°) Re (4353°); Th (2023°).
Все тугоплавкие металлы (кроме Be) образуют галогенидные соединения высшей валентности, которые в контакте с металлом (а для некоторых - с водородом) при высокой температуре восстанавливаются до соединений низшей валентности.
Таблица 46
Температура плавления и кипения некоторых галогенидов тугоплавких металлов
| Галогенид | tпл, °К | Tкипo K, при которой р'МеС1n= 760 мм pm. cm. | Галогенид | tпл, °К | Tкипo K, при которой р'МеС1n= 760 мм pm. cm. |
| BeCl2 | MoCl5 | ||||
| YCl3 | — | WCl6 | 619,7 | ||
| TiCl4 | 409,5 | WCl5 | 548,6 | ||
| TiCl3 | 1023-1123 (возг.) | ВеF2 | 1073 (возг.) | ||
| TiCl2 | TiF4 | — | |||
| ZrCl4 | (под давл.) | 604-903 (возг.) | ZrF4 | (1200) | (1200) (возг.) |
| ZrCl3 | (900) | — | ZrF3 | (1600) | (2373) |
| ZrCl2 | (1000) | (1753) | ZrF2 | (1800) | |
| HfCl4 | (под давл.) | HfF4 | (1203) | (1173) | |
| ThCl4 | NbF5 | 507,9 | |||
| VCl4 | TaF5 | 368,1 | 502,2 | ||
| NbCl5 | 482,5 | 527,0 | MoF6 | ||
| ТаCl5 | 493,0 | 512,3 | WF6 | 275,5 | 292,5 |
Примечание. Числа в скобках - ориентировочные данные.
Галогенидные соединения высшей валентности тугоплавких металлов в основном имеют ковалентную связь, практически не электропроводны, плавятся и кипят при низкой температуре (табл..46).
С галогенидами щелочных и щелочноземельных металлов образуются соединения типа NanMeXm+n, в которых тугоплавкие металлы входят в комплексный анион. Фторидные комплексы наиболее прочны. При разряде катионов тугоплавких металлов на катоде образуются кристаллы металла, так как температура электролита в этом случае всегда ниже температуры плавления выделяемого металла.
Широкое внедрение в технологию редких металлов хлорного метода переработки рудных концентратов позволяет получить достаточно чистые хлориды (применяя метод раздельной конденсации), которые после дополнительной очистки возгонкой, ректификацией и т. и. являются исходными соединениями для получения металлов электролизом.
Вследствие ковалентности связи большинство хлоридов тугоплавких металлов слабо проводят электричество. Кроме того, сравнительно низкая температура кипения (или возгонки) определяет высокое давление пара хлоридов при температуре электролиза. Поэтому электролиз расплавов чистых хлоридов тугоплавких металлов практически невозможен. Электролиз ведут из их смеси с КСl или NaCl. При этом образуются химические соединения, понижающие давление пара хлоридов над расплавом. Обычно в электролите концентрацию хлоридов тугоплавких металлов поддерживают 3-12 мол. %, а температуру 950-1200° К. Концентрация хлоридов тугоплавких металлов должна быть достаточной, чтобы не допустить возникновения концентрационной поляризации на катоде, что может вызвать разряд посторонних ионов, снизить выход по току и чистоту получаемого металла.
Материалом анода обычно служит графит. В случае электролитического рафинирования анод изготовляют из блока очищаемого металла или металл в виде стружки и обрезков помещают в сетчатые корзины, располагаемые вокруг катода (металл сетки заметно электроположительнее очищаемого металла). Катодами обычно служат цилиндрические стержни различных диаметров либо металлические пластины. Металл катода не должен реагировать с расплавом и металлом, на нем осаждаемым. Чаще всего применяют стандартные жаропрочные стали. Нередко катодом служат стержни или пластины того металла, который подвергается в данном случае электролитическому осаждению.
Электролизер простейшего типа состоит из стального котла, вставленного в печь, обогреваемую электрическим током или газом. В котел помещается стальной стакан, в котором и происходит процесс электролиза (стакан при этом служит катодом). Котел герметически закрывается крышкой, в центре которой находится графитовый анод. В крышке имеются также патрубки для отвода хлора, подачи аргона под давлением и слива электролита под давлением. Электролит по мере обеднения пополняют солью металла. По окончании цикла электролит сливают, электролизер разбирают, стакан вытаскивают, осадок промывают горячей водой (или слабой кислотой) и снимают со стенок. Процесс в таком электролизере периодический.
Часто используют открытые электролизеры непрерывного действия. При этом процесс осуществляется на воздухе, что может существенно сказаться на качестве получаемого металла. Стальной котел электролизера (рис. 78) охлаждают водой, вследствие чего на стенках и днище образуется гарниссаж из соли, не допускающей реакции материала стенок с расплавом. Нужную температуру поддерживают переменным током, подаваемым на пару электродов. В электролизер заливают расплавленный электролит, после чего включают ток - переменный и постоянный. Хлор удаляют посредством бортового отсоса. На стержнях-катодах образуется масса, состоящая из металлических кристаллов различной крупности и электролита («груша»). Электролизер питают твердой солью.
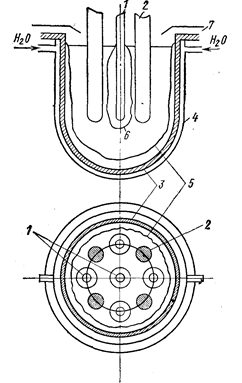
Рис. 78. Схема электролизера непрерывного действия (Ваймаков Ю. В., Ветюков М. М. 1966, с. 516, рис. 157):
1-стальные или молибденовые катоды; 2-графитовые аноды: 3-корпус ванны (сталь); 4-кожух водяного охлаждения; 5- гарниссаж из электролита: 6 - катодный осадок; 7 - бортовой отсос.
Катодных стержней обычно несколько (например, четыре анода и пять катодов). По мере образования осадка катодные стержни поочередно извлекают из расплава, процесс электролиза при этом не прерывается. Извлеченную «грушу» обжимают прессом над ванной для удаления из нее части электролита. Осажденный металл всегда содержит заметное количество азота и кислорода.
Для предотвращения контакта металла с воздухом предложена конструкция герметического электролизера непрерывного действия (рис. 79).
Компоненты электролита переплавляют в вакууме и хранят в герметичной таре. Перед пуском электролизер заливают электролитом, включают переменный ток, откачивают воздух и промывают аппарат аргоном. Электролизер может быть снабжен патрубками для спуска электролита и шлама.
Современные требования к чистоте получаемых тугоплавких металлов очень высоки, поэтому применяют только специально очищенные и перекристаллизованные в перегнанной воде соли. Аргон и гелий для промывки аппаратов очищают сорбцией на глиноземе, пятиокисью фосфора и сорбцией на губчатом титане при 800° С.
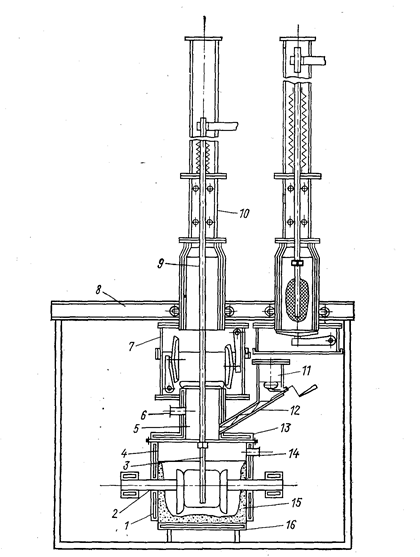
Рис. 79. Схема герметичного электролизера со сменными катодами (Баймаков Ю. В., Ветюков М. М., 1966, с. 517, рис. 158):
1 - стальные водоохлаждаемые стенки; 2 - четыре графитовых анода (из них два питаются переменным током для поддержания нужной температуры в электролите); 3 - никелевый катод, присоединенный к полому водоохлаждаемому стальному катодо-держателю; 4 - сварной герметизированный корпус электролизера; 5 - переходный патрубок на крышке; 6 - патрубок для удаления газов, ванна имеет патрубок для спуска электролита и шлама; 7 - разъемный шлюз с крышками, закрывающими электролизер н камеру, шлюз двигается на роликах; 8 - рама для передвижения камер; 9 - катододер-жатель; 10 - камера для приема и охлаждения осадка без доступа воздуха; 11 - герметичный загрузочный бункер с вакуумными затворами; 12 - питатель для подачи в ванну свежего электролита и корректирующих добавок; 13 - водоохлаждаемая крышка на ванне с резиновой прокладкой и охлаждением; 14 - патрубок для подачи инертного газа и для откачки воздуха; 15 - гарниссаж на стенках и днище ванны; 16 - стальное водоохлаждаемое днище.
Бериллий
Электролитическое восстановление бериллия из водных растворов невозможно, так как его галогенидные соли подвержены гидролизу и ионы сильно гидратированы. Используют расплав состоящий из BeCl2-NaCl. Эвтектика с содержанием 50 мол % BeCl2 плавится при 215° С. Потенциал разложения BeCl2 E =2,04-0,00055 (T-773° К) в, а в эквимолярнои смеси E873 K =1,99 в; E973°K = 1,73 в. Потенциал разложения зависит от концентрации BeCl2 в расплаве, Е773 К = 1,962 + 0,244/N2 , где N - мольная доля BeCl2.
В промышленных условиях в качестве электролита используют смесь BeCl2 - (NaCl + KCl) в отношении 1:1. Электролиз проводят в электролизерах периодического действия. Плотность тока на аноде 0,37 а/см2, на катоде 0,08 а/см2, сила тока до 2000 а, напряжение на ванне 4-6 в. Выход по току 70-80% удельный расход энергии 32-50 квт. ч/кг. В расплаве поддерживают концентрацию BeCl2 5-7 масс. %. Кристаллы бериллия отмывают от солей, раствор солей направляют на регенерацию (с получением Be(ОН)2). Используя сменные катоды можно очищать электролит предварительным электролизом, при этом осаждаются более электроположительные примеси, и катод заменяют на новый для осаждения бериллия.
Чистоту металла, получаемого в результате электролиза, характеризуют следующие данные по примесям, масс. %:
| B | 1.10-5 | Al | 3.10-3 | Ca | 1,4.10-3 |
| Li | 1.10-5 | Si | 2,4.10-2 | Cl | 2,2.10-3 |
| Ag | 1.10-4 | Cd | 6.10-6 | S | 1.10-2 |
| Mn | 2,3.10-3 | Co | 1.10-4 | Sn | 5.10-3 |
| Cu | 1,7.10-3 | Ni | 3.10-3 | P | 1.10-2 |
| Fe | 7.10-3 | Zn | 1,6.10-3 | F | 5.10-2 |
| Mg | 1.10-3 | Ti | 1.10-3 | Pb | 1.10-2 |
| Ba | 6,6.10-3 | Cr | 8.10-4 |
Металл такой чистоты не удовлетворяет требованиям, предъявляемым специальным машиностроением. В настоящее время бериллий высокой чистоты получают из особо очищенной окиси бериллия, прохлорированной и возогнанной в вакууме Электролиз ведут в герметичном электролизере с непрерывной подпиткой BeCl2 из герметичного бункера. Получающийся металл дополнительно очищают электролитическим рафинированием - проведением электролиза в тех же условиях с расходуемым анодом.
Наиболее существенными недостатками электролитического процесса являются: корродирование электролизера, большое давление пара хлоридов при температуре электролиза и трудность отделения бериллия от расплава.
Возможен электролиз расплава фторида бериллия. В этом случае в качестве электролита, применяют NaF- BeF2 или BaF2-BeF2. Электролиз смеси NaF-BeF2 . проводят при температуре около 600° С с получением твердых кристаллов металла, смеси BaF2-BeF2 - при температуре 1400° С с получением расплавленного металла. Катодом служит никелевый или железный стержень. Однако применение для электролиза фторидов не решает проблемы летучести электролита, коррозия электролизеров при этом даже увеличивается. С другой стороны, образование во фторидной системе прочных комплексов бериллия снижает выход по току вследствие частичного выделения металлов-примесей. Электролиз фторидов в настоящее время в промышленности не применяют.
Металлический бериллий получают в основном металлотермическим восстановлением фторидов. Удельный вес электролиза в общем объеме производства металла составляет всего ~15%. Одной из причин этого является высокая летучесть хлоридов, которые могут образовывать весьма ядовитые аэрозоли.
Титан.
Для электролиза используют галогенидные соединения титана, преимущественно хлориды, растворенные в расплавах NaCl и КСl. Растворимость TiCl4 в LiCl и КСl доходит до 1,5 масс.%. В CsCl она возрастает до 6%. Добавки NaF повышают растворимость до 2-4% (в 10-20%-ном NaF). Повышение растворимости объясняется образованием комплексной соли Na2TiFe.
Низшие хлориды титана растворимы в расплавленных хлоридах калия и натрия с образованием комплексных соединений: К3ТiСl6 и KtiCl4; KTiCl3 и K2TiCl4.
Металлический титан реагирует с нонами высшей валентности, восстанавливая их:
3TiCl4 + Ti « 4TiCl3 lg K = - 4,09 + 10347/T;
TiCl4 + Ti « 2TiCl2 lg K = - 1,998 + 7968/T;
2TiCl3 + Ti « 2TiCl2 lg K = - 5,038 + 6774/T;
При 1000° К в расплаве NaCl-KCl, - содержащем 6,7 масс. % титана в виде хлорида, в равновесном состоянии с металлом на долю ионов Ti2+ приходится 95-96%, Ti3+- 4,1% и Ti4+- только 1.10-5%.
Установлено существование монохлорида титана, образующегося по реакции TiCl2+Ti « 2TiCl. Монохлорид существует при повышенной температуре и чрезвычайно нестоек. Образование и распад монохлорида вызывают появление дисперсной металлической фазы в расплаве.
Существуют два метода электролитического получения титана: 1) электролиз TiCl4 с применением графитового анода; 2) электролитическое рафинирование титана в расплавах низших хлоридов с расходуемым анодом.
Добавление в электролизер летучего хлорида — технически трудно осуществимый процесс. Обычно в этом случае применяют электролизеры с двойным дном (схема подачи летучего хлорида представлена на рис. 80).
На катоде происходит восстановление до TiCl3 и TiCl2 (молекулы низших хлоридов диффундируют в расплав) и восстановление Тi3+ и Ti2+ до металла. На аноде происходит окисление анионов хлора. Выход по току (по хлору) равен 94%. Наиболее благоприятная температура 800° С. Анодная плотность тока 0,8 a/cм2. Понижение анодной плотности тока приводит к уменьшению анодного выхода по току, при повышении возможно возникновение анодного эффекта.
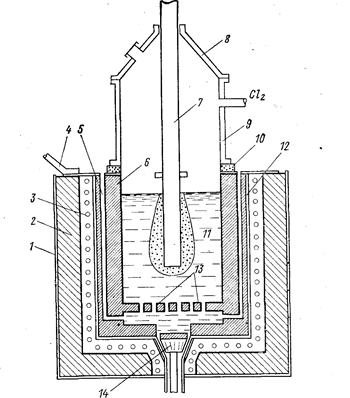
Рис. 80. Схема электролизера для электролитического получения тугоплавкого металла с подачей легкокипящих жидких хлоридов (Баймаков Ю. В., Ветюков М. М., 1966, с. 518, рис. 159):
1 - наружный кожух; 2 - теплоизоляция; 3 - электронагреватели; 4 - анодный токопод-вод; 5 - вертикальные каналы для подачи жидкого хлорида; 6 - цилиндрический графитовый анод; 7 - катод из жаропрочной стали; 8 - съемный колпак; 9 - верхний кожух из жаропрочной стали; 10 - электроизоляция; 11 - электролит; 12 - внутренний кожух из жаропрочной стали; 13 - ложное днище с отверстиями для подачи испаряющегося хлорида; 14 - пробка для спуска электролита.
При повышении плотности тока на катоде выделяется щелочной металл или его субион (Na2+), который восстанавливает TiCl4 до TiCl3 и TiCl2. Низшие хлориды на катоде восстанавливаются до металла.
В настоящее время применяют расплавы состава 50% NaCl - 30% KCl -10% NaF. Электролиз ведут при 680-700° С, плотность тока на катоде достигает 8 а/см2, при этом выход по току ~ 70%, напряжение на ячейке 6 в. Металл содержит некоторое количество углерода (из анодов), и при недостаточной герметизации аппаратуры может иметь место повышенное содержание кислорода и азота. Катодный осадок состоит из чрезвычайно мелких кристаллов, так как на катоде протекают реакции поляризации ионов, нарушающие рост кристаллов.
Однако подбором оптимального сочетания катодной и анодной плотностей тока, удельной скорости подачи TiCl4 и конструкции электролизера (взаимного расположения анода и катода) можно достигнуть такого сочетания протекающих реакций, при котором соотношение TiCl3 и TiCl2 в расплаве обеспечило бы получение более крупных кристаллов.
Необходимость получения чистого титана, а также переработки некондиционной титановой губки, отходов титанового литья и механической обработки послужила толчком для разработки процесса электролитического рафинирования металла.
Элетролитическое рафинирование проводят в герметически закрытых электролизерах, заполненных аргоном. Куски губки, стружку и т. п. помещают в сетчатые стальные корзины, которые служат анодом. Электролитом служит расплав NaCl- TiCl3 – 8-15 масс. % TiCl2 при температуре 850-900° С, а катодом - стальные стержни.
На титановом аноде в первую очередь идет реакция Ti®Ti2++2e-. По мере увеличения поляризации и плотности тока начинает идти реакция Ti®Ti3++3e-. Первая реакция идет при напряжении 2,1-2,2 в. При плотности тока на аноде 0,1 а/см2 практически образуются лишь ионы Ti2+, а при плотности тока 0,4-0,5 а/см2 ионы Ti2+ и Ti3+ переходят в расплав в равных долях.
На катоде электрохимические реакции идут в обратном порядке: Ti3++e-®Ti2+, Ti3++3e-®Ti, Ti2++2e-®Ti. По мере увеличения плотности тока последовательно начинают проходить три приведенные реакции; дальнейшее увеличение напряжения вызывает появление предельного тока и начало разряда ионов натрия.
При прохождении тока через ячейку электролитического рафинирования количество ионов титана, образующихся на аноде, не совпадает с их количеством, разряжающимся на катоде. Пересчет количества электричества, прошедшего через ячейку, на количество растворившегося и выделившегося металла позволяет определить средний заряд ионов, образующихся на аноде (2,03-2,1) и разряжающихся на катоде (2,5-2,3). Казалось бы, что в этих условиях расплав должен обогащаться ионами титана. Но на самом деле, напротив, расплав обедняется ионами титана. Это вызвано протеканием в расплаве реакции диспропорционирования 2TiCl2 ® Ti + TiCl4. Часть ионов Ti2+ уходит из расплава. В промышленных условиях эту убыль приходится компенсировать добавлением расплава NaCl – 40-50 масс. % (TiCl3- TiCl2).
Оптимальная исходная концентрация TiCl3 в расплаве 4-5 масс.%. Концентрация TiCl2 в процессе электролиза устанавливается 80% общего количества хлорида титана в расплаве. Анодная плотность тока 0,1-0,3 а/см2, катодная 1,8-3 а/см2, температура 800° С. Выход по току около 80% отвечает валентности 2.
Стальной катод сначала покрывается тонкой пленкой титана вследствие диспропорционирования TiCl2 и TiCl, затем осадок формируется в виде уплотненного скопления призмочёк. Размеры кристаллов увеличиваются с понижением плотности тока и повышением температуры. Кристаллизация улучшается в отсутствие ионов Ti3+. Понижение концентрации хлоридов титана в расплаве вызывает измельчение кристаллов. К такому же эффекту приводит присутствие в расплаве кислородных соединений, углерода, азота, ионов Аl3+, Mg2+, V4+, Ni2+ и некоторых других.
Получаемая очистка от железа, кремния, кислорода, водорода и азота удовлетворительна. Ионы некоторых примесей переходят в катодный осадок.
Электролит для рафинирования проще всего приготовить, пропуская пары TiCl4 через расплав NaCl, содержащий титановую губку при температуре 850° С. Таким образом готовят расплав с содержанием до 40% TiCl2- TiCl3Т1.
Аппаратуру изготовляют из стали марки Ст. 2. Электролизер обязательно имеет в днище отверстие для слива шлама с отработанным электролитом.
Осадок металла сбивают с катода, обрабатывают подкисленной дистиллированной водой, промывают, сушат в вакууме и рассеивают по крупности.
Электролизеры сооружаются на 10-30 ка. Напряжение на ванне 8-11 в. Выход по току колеблется от 60 до 85%. Расход энергии на 1 т металла 15000 кет-ч. Кроме того, на нагревание электролизера затрачивается 8000-10000 квт.ч переменного тока на 1 т металла.
Цирконий и гафний
Цирконий и гафний в расплавах образуют ионы Me4+, Me2+ и неустойчивые Ме+. Хлориды и фториды четырехвалентных металлов - ковалентные химические соединения, образующие с галогенидами щелочных металлов в расплавах комплексные соединения (такие, как Me2ZrF6, где Me=Na, К; Me3ZrF7 и т. п.).
Электрохимическим путем цирконий получают из расплавов смесей КСl-K2ZrF6 и NaCl- K2ZrF6. В этих расплавах в результате обменной реакции образуется комплексный анион ZrFeCl3-.
При взаимодействии иона циркония с металлом протекает реакция: Zr4++Zr«2Zr2+, lg K800oC = 10,2. В присутствии металла в расплаве преобладают ионы Zr2+.
Электролитическое получение технического циркония в настоящее время осуществляют в открытых электролизерах на ток 2000-6000 а.
'На аноде окисляется ион хлора. Суммарная реакция на электродах K2ZrF6 + 4KCl ± e- « Zr + 2Cl2 + 6KF.
Во время электролиза в электролит периодически вводят порции соли K2ZrF6-КС1. В электролите должны накапливаться ионы F+ и К+. Однако содержание фтора в электролите балансируется тем, что значительное количество расплава с повышенным содержанием KF захватывается катодным осадком, часть электролита уходит со шламом, выпускаемым периодически из ванны. На катоде образуется осадок, содержащий металл, электролит, низшие фториды циркония. Его подвергают дроблению, обрабатывают горячей водой, подкисленной НС1 (100 г/л), металл отмывают от шлама низших фторидов, сушат в вакууме при 60-100° С и рассеивают по фракциям.
Из сравнения данных по потенциалам разложения хлоридов циркония и гафния видно, что значение потенциалов для Hf/Hf4+ несколько электроотрицательнее (EoHfCl4 = 2,59-0,615.10-3 T в), чем для Zr/Zr4+ (EoЯкCl4 = 2,34 – 0,48.10-3 T в), однако для двухвалентных хлоридов картина обратная (EoHfCl2 = 2,51 – 0,4.10-3 T в; EoZrCl2 = 2,54 – 0,53.10-3 T в). Поэтому катионы Zr4+ и Hf4+ разряжаются одновременно. В смешанных фторидно-хлоридных растворах потенциал гафния отрицательнее потенциала циркония; разность при 700° С составляет 0,06 в, а при 800° С - 0,02 в. Термодинамически, следовательно, разделение на катоде возможно, однако при наложении кинетического фактора w многообразии катодных реакций раздельный разряд Zr4+- и Hf4+ становится маловероятным. Происходит лишь частичное обогащение катодного осадка по цирконию.
Электролитическое рафинирование циркония протекает аналогично рафинированию титана. При этом достигается хорошая очистка от кислорода, азота и водорода.
Для получения электролитического циркония достаточной. степени чистоты за одну операцию (без дополнительной очистки) процесс ведут в герметичном электролизере (см. рис. 79). Кристаллы K2ZrF6 дважды перекристаллизовывают и сушат в вакууме при 80° С.
Химически чистый КСl обезвоживают в муфельной печи при температуре 350-400° С. Состав расплава: 30-70% КСl, 10-30% K2ZrF6, 20-40% KF. Температура электролиза 750-800° С, катодная плотность тока 0,3-0,5 а/см2, выход пo току 50-60%. Продолжительность наращивания катодной «груши» 2-2,5 ч. В процессе электролиза для корректировки состава электролита в ванну вносят 20 г K2ZrF6 и 25 г КСl на каждые 10 а.ч, пропущенные через электролит. В открытых электролизерах чистота металла не превышает 0,3-0,4% по кислороду и 0,01% по азоту, а в герметичных электролизерах с защитной атмосферой содержание кислорода 0,06%, азота 0,003%. Катодный осадок содержит 30% металла и электролит.
Электрохимическое поведение гафния в основном подобно поведению циркония.
Ниобий и тантал
NbCl5, TaCl5, NbF5 и TaF5 образуют комплексные соединения типа K2MeF7. Фторниобат калия легко гидролизуется до K2NbOF5.Н2О. Фтортанталат более устойчив. При восстановлении образуются галогениды низших валентностей.
Компонентами электролита для получения обоих металлов служат КСl, K2MeF7, KF, в некоторых случаях используют окислы, растворяющиеся во фторидном расплаве. Значения потенциала разложения следующие:
EoNbCl5 = 1,94 - 0,50.10-3 Тв; EoТаCl5 = 2,47 (298 К) в;
EoNbCl3 = 1,76 - 0,467.10-3 Тв; EoNbCl5 = 2,0 (1023 К) в;
Процесс электролиза ведут с высокой катодной плотностью тока 1-2 а/см2, что позволяет достигнуть потенциала разряда ионов Me3+ и Me2+ и предотвратить их накопление и диспропорционирование.
При получении технических ниобия и тантала применяют открытые электролизеры. Материал катода - молибден. Состав электролита: 9-10% K2MeF7, 4-8-% Me2O5, 25-42% КС1, 44-57% KF.
Введение в электролит растворенных окислов улучшает смачиваемость анода и повышает критическую силу тока, выбывающую анодный эффект. Улучшение смачивания объясняется тем, что окислы в данном случае являются поверхностно-активными веществами. Добавка растворимых окислов в расплаве уменьшает краевой угол смачивания.
Температура электролиза 750° С, выход по току 80%. Чистота технического Та, масс. %: 0,1-0,2 О, 0,1-0,3 Fe+Ni, 0,01 F, 0,002 Mn, 0,003-0,1 С.
Для получения металлов повышенной чистоты применяют электролиты без Ме2О5 в герметичном электролизере (см. рис. 79). Состав электролита: 55% КСl, 27,5% KF, 17,5% K2MeF7. Температура 700-800° С, катодная плотность тока 0,6-0,8 а/см2, анодная 1,5-2,3 а/см2. Получающийся ниобий содержит, масс. %: 0,02 С; <0,05 О; 0,02 N.
Применяют в технологии и процесс электролитического рафинирования с растворимым анодом, приготовленным из металлического порошка методом металлокерамики. В данном случае применяют хлоридный электролит, состоящий из КСl, NaCl, МеСl3. Во фторидных расплавах ионы Nb5+ и Та5+ связаны в прочный комплекс, и для их выделения необходимо приложить большее напряжение, что влечет за собой совместный разряд, более электроотрицательных ионов (Al3+ и др.). Проведение электролиза в закрытых электролизерах улучшает чистоту получаемого металла. При этом электролит удаляют из катодного осадка вакуумной сепарацией при 1800-2000° С.
Редкоземельные металлы
Электролитом служат расплавы хлоридов и фторидов щелочных и щелочноземельных металлов. Более легкоплавкие редкоземельные металлы с температурой плавления 800-1000° С получают в открытых электролизерах с подиной-катодом, более (1300-1750°С) тугоплавкие в закрытых электролизерах с вертикальным катодом. Данные о температурах плавления редкоземельных металлов представлены в табл.47.
Таблица 47
Дата добавления: 2019-04-03; просмотров: 437;
