Физико-химические свойства жидких солевых систем
Плотность
Плотность - одно из наиболее доступных для измерения свойств расплавов. Мольный и удельный объемы в идеальных системах—величины аддитивные, что позволяет по отклонению от аддитивности судить о строении смесей солей:
u = 1/r см3/г; V = uM = M/r,
где u - удельный объем; r - плотность; V - мольный объем; М - молекулярная масса.
Молекулярная масса смеси по правилу аддитивности:
Mсм = MАNA + MВNВ,
где Mсм - молекулярная масса смеси; MА,MВ - молекулярная масса компонентов; N - мольные доли.
Для практики электролиза часто необходимо знать соотношение плотности электролита и металла при данной температуре (оно определяет скорость всплывания или опускания на дно электролизера корольков металла). Плотность большинства расплавленных солей и их смесей падает с температурой по линейному закону:
rT = r0 – (t - t0) (85)
Для систем, представленных диаграммами плавкости рис. 75, а, б и иногда в, мольные объемы обычно аддитивны. Образование химических соединений в двойных системах часто сопровождается сжатием.
Вязкость
Коэффициентом вязкости или внутреннего трения называется коэффициент пропорциональности в уравнении Ньютона для силы трения между двумя слоями жидкости, движущимися параллельно и ламинарно:
f = hF dw/dx, (86)
где f - сила трения, н; h - вязкость; F - площадь соприкосновения слоев, м2; dw/dx - градиент скорости между слоями по нормали к направлению потока, сек-1.
Вязкость обычно выражается в пуазах (1 пз=1 дин.сек/см2 =0,1 н.сек/м2}. Вязкость воды при 20° С и 1 ат равна 1,0087 спз. Величина, обратная вязкости, называется текучестью.
В техническом электролизе мы имеем дело с движением жидкости относительно неподвижных электродов, с перемещением капель металла и пузырьков газа в электролите. Для качественной и количественной характеристик этих процессов необходимо знать вязкость электролита. Вязкость расплава LiCl при температуре 617°С равна 1,81 спз, КС1 (t = 790°С) - 1,42 спз.
Вязкость расплавленных солей падает с ростом температуры. Температурная зависимость вязкости имеет вид
h= Aexp(Eh/kT), (87)
где Eh - энергия активации вязкого течения, ккал/моль; k - константа Больцмана, ккал/град; Т - абсолютная температура.
Считается, что вязкость смеси определяется наиболее громоздкими частицами, так как их переход в соседнее равновесное положение—самый медленный процесс (наибольшая энергия активации). Анионы, как правило, превосходят по размерам катионы, а расплавы соли со сложными анионами (например, Сr2О72- и т. п.) имеют повышенную вязкость. Повышается вязкость и в системах, где возможно образование сложных частиц типа автокомплексных ионов (MgCl2, CdCl2, CaCl2 и т. п.).
Вязкость - свойство не аддитивное, и для идеальных систем изотермы вязкости являются монотонными кривыми, выпуклыми к оси состава. Химическое взаимодействие компонентов в ионных системах приводит к укрупнению ионов (комплексные ионы), при этом на изотермах вязкости можно ожидать резких максимумов или точек перегиба. Появление в гомогенной жидкости взвешенных твердых частиц приводит к резкому возрастанию вязкости.
Поверхностные явления
Образование и рост кристаллов на электроде, образование капель жидкого металла на катоде, всплывание металла в электролите, растворение металла в расплавленных солях, вопросы смачивания, пропитывания солями футеровки электролизера - все эти процессы во многом определяются межфазным натяжением, существующим на соответствующей границе раздела фаз.
Частицы жидкости, находящиеся в поверхностном слое на границе с газом, притягиваются, внутрь жидкости. Эта поверхностная пленка стремится сжать жидкость, поэтому при увеличении поверхности жидкости приходится затрачивать работу. Эта работа, отнесенная к 1 см2 новой поверхности жидкости, называется поверхностным натяжением о и измеряется в эрг/см2.
Поверхностное натяжение мало зависит от природы газа, с которым соприкасается жидкость, так как силы взаимодействия между частицами жидкости намного больше, чем силы, действующие между частицами жидкости и газа. Рост температуры приводит к уменьшению сил взаимодействия между частицами жидкости и к уменьшению поверхностного натяжения:
st = a - b{t - tпл), (88)
где st - поверхностное натяжение при температуре t °C; tпл - температура плавления; а и b - постоянные для данной соли.
Рост радиуса катиона в ряду солей с одноименным анионом приводит к падению сил межионного притяжения и, .следовательно, к уменьшению а. Однако рост радиуса катиона может приводить к уменьшению взаимной поляризуемости катиона и аниона, уменьшению доли ковалентности связи и, следовательно, к росту сил межионного притяжения и росту s.
Для идеальных смесей изотерма поверхностного натяжения представляет собой кривую с небольшой выпуклостью к оси состава.
Естественно, что чем больше напряженность собственного поля частицы или чем больше ее обобщенный момент ne/r, тем прочнее она удерживается окружающими ионами. Следовательно, частицы с меньшим обобщенным моментом должны «выталкиваться» в поверхностный слой, где их концентрация больше, чем во всей массе жидкости. Такие вещества называются поверхностно-активными, и с повышением их концентрации в пограничном слое поверхностное натяжение падает. Образование комплексных частиц должно приводить к падению величины а, так как образующиеся частицы имеют значительные размеры и малый обобщенный момент и должны быть поверхностно-активными.
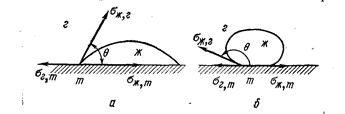
Рис. 76. Схема сил межфазного натяжения, действующих на частицу жидкости, лежащую на границе трех фаз (Баймаков Ю. В., Ветюков М. М., 1966, с. 43, рис. б):
a - жидкость хорошо смачивает твердое тело; sг,ж > sж,т; cosq >0; б - жидкость плохо смачивает твердое тело; sг,ж < sж,т; cosq <0.
Если нанести каплю жидкости на ровную поверхность твердого тела, то жидкость либо смачивает поверхность и растекается, либо плохо смачивает и сжимается в каплю. Частица жидкости, лежащая на границе трех фаз, подвержена действию трех сил межфазного натяжения на границах (рис. 76): газ - твердое (sг,т), жидкое-твердое (sж,т) и жидкое-газ (sж,г). Условие равновесия частицы - равенство проекции сил на горизонтальную линию:
sг,т = sж,т + sж,гcos q (89)
где q - краевой угол смачивания; cos q = (sг,т - sж,т) / sж,г.
В табл. 40 приведены данные по смачиванию поверхности угля расплавами некоторых солей.
Таблица 40
Дата добавления: 2019-04-03; просмотров: 552;
