Физиологически активные соединения, взаимодействующие с серотониновым рецептором
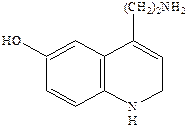
Серотонин или 5‑гидрокситриптамин (5НТ) является биогенным амином, образующимся в организме в результате превращения аминокислоты триптофана. Серотонин содержится в различных органах, тканях, тромбоцитах и в мозге. В нервной системе синтез серотонина происходит в цитоплазме нервных окончаний. Он накапливается в синаптических пузырьках, выделяется под влиянием нервных импульсов и взаимодействует со специфическими рецепторами, обозначаемыми как серотониновые (серотонин‑R‑ические). Серотониновые рецепторы содержатся в периферических тканях. Причем разделяются следующие подтипы: 5НТ1, 5НТ2, 5НТ3.
5НТ2 рецепторы содержатся в гладких мышцах стенок сосудов, в бронхах.
5НТ1 и 5НТ3 находятся в гладкой мускулатуре и в слизистой оболочке желудочно-кишечного тракта.
5НТ3 в центральной нервной системе и периферических тканях.
Известно, что физиологическая роль серотонина в головном мозге человека заключается в регуляции различных психоэмоциональных реакций. Кроме того, серотонин участвует в контроле терморегуляции, процессов сенсорного восприятия, в частности чувствительности к боли. В последующие годы было показано, что нарушение обмена серотонина и функций серотониновых регуляторов имеют отношение к патогенезу наркомании, алкоголизма и т.д. Эти факты и явились причиной возросшего интереса к изучению химических соединений, участвующих в нейропередаче серотонина.
Серотонин отличается чрезвычайно широким спектром биологической активности по отношению к центральной нервной системе и другим органам. С влиянием на биосинтез серотонина, его метаболизм и взаимодействие с рецепторами связан механизм действия ряда психотропных препаратов. Большая роль серотонину придается в механизме действия антидепрессантов.
Серотониновые рецепторы представляют собой белковые молекулы, встроенные в плазматические мембраны клеток и трансформирующие молекулярный сигнал серотонина и его аналогов в специальный ответ клетки. Действие большинства соединений используемых для лечения различных умственных расстройств, ожирения, мигрени основана на их участии в серотонин‑R‑ической передаче. Эти вещества выступают в роли агонистов или антагонистов соответствующих рецепторов. Очевидно, что антагонисты не обладают внутренней активностью. Возможно также существование частичных агонистов, не способных произвести максимально активных рецепторов, а следовательно, и максимальный биологический ответ независимо от применяемого количества.
Активация серотониновых рецепторов приводит к инициированию механизма с участием цепочки мембранных белков, последовательно взаимодействующих друг с другом. На определенной стадии передача сигнала продолжается с помощью вторичных мессенджеров («посыльные») – молекул или ионов, которые в итоге вызывают изменения конфигурации белков, участвующих в специфических клеточных процессах.
Открытие различных подтипов серотониновых рецепторов привело к осознанию того факта, что большинство из известных лекарственных соединений, влиящих на серотонин‑R‑ическую передачу, действуют одновременно на несколько подтипов 5НТ рецепторов. Например, 5НТ3 рецептор образует ионный канал и передает сигнал непосредственно от нервных клеток за счет возникновения тока ионов, поэтому разработка селективных лигандов, приводящих к более эффективному лечению с меньшими побочными эффектами была и есть задача номер один нервных болезней, не говоря уже о том, что разработка селективных лигандов может привести к созданию принципиально новых форм терапии.
Серотониновые рецепторы найдены в высоких концентрациях в коре головного мозга, где, как полагают, они играют существенную роль в процессах возникновения эмоций. Лиганды, особенно агонисты, взаимодействующие с рецепторами были предложены в качестве терапевтических средств для лечения состояния страха, как обезболивающие средства и т.п.
Простейшие структурные модификации молекулы серотонина – введение различных заместителей в бензольное кольцо или ограничение конформационной подвижности в боковой цепи молекулы – привели к нескольким высоко аффинным агонистам 5НТ1 рецепторов, например,
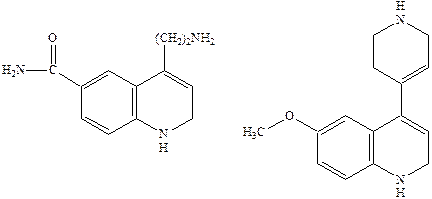
Однако указанные соединения как и сам серотонин не являются селективными и взаимодействуют с разными подтипами серотониновых рецепторов.
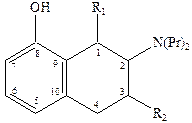
8‑гидрокси‑2‑дипропиламинотетралин оказался одним из наиболее активных селективных агонистов 5НТ1 рецепторов, причем полным агонистом является только (+)‑R‑энантиомер, который к тому же имеет приблизительно в двое большую активность.
Основные закономерности «структура-свойства» для тетралинов следующие:
1) Наличие гидроксильной группы в положении 8 необходимо для связывания. Обеспечивает 500‑кратную селективность к серотониновым рецепторам по сравнению с дофаминами.
2) Наличие второй гидроксильной группы в положении 5 или 7 приводит к резкому снижению селективности.
3) Возможна замена гидроксильной группы на метокси (-OCH3) и ацильную и некоторые другие, но не на карбоксильную, без потери аффинности и селективности, хотя при этом иногда сильно уменьшается агонистическая активность.
4) Оптимальным для аффинности, селективности и агонистической активности является наличие двух пропильных заместителей у атома азота, хотя некоторая вариация заместителей, например, Pr заменить на ‑CH2-CH=CHI, тоже дает хороший результат и приводит к значительному улучшению связывания полученного лиганда с рецептором.
5) Введение небольших заместителей R1 и R2 = ‑CH3 приводит к существенным различиям в активности полученных соединений.
6) Переход к три и тетрациклическим структурам, например, апоморфин, привел к созданию селективных сильных агонистов 5НТ1 рецепторов.
Основной проблемой в дизайне новых лигандов является обеспечение селективности, т.к. семейство серотониновых рецепторов характеризуется широким набором структурно похожих подклассов, и прогресс остается за рентгеноструктурными анализом, ибо только с его помощью можно уточнить компьютерные модели по докингу лидеров различных структурных классов.
Дата добавления: 2019-02-07; просмотров: 472;
