Противомикробные препараты
Наиболее часто причиной заболевания человека и животных является проникновение в организм болезнетворных возбудителей, а именно: вирусов, микробов, грибков, простейших, гельминтов (паразиты, например, бычий цепень, аскарида), а также перерождение нормальной клетки в раковую.
Для лечения таких заболеваний используют лекарственные препараты, действующие на болезнетворного возбудителя или раковую клетку. В зависимости от того, на какой возбудитель действует лекарственный препарат, различают противомикробные, противопаразитарные, противовирусные, противогрибковые и препараты для лечения злокачественных новообразований. Отметим, что борьба с болезнетворными бактериями это один из наиболее успешных разделов медицинской химии. Впервые идентификация болезнетворных бактерий осуществлена Ван Левенгуком после открытия микроскопа в 1870 году. В середине XIX века были выявлены бактерии ответственные за холеру, тиф, туберкулез.
Использование бактерий в роли бактериологического оружия представляет собой страшную силу, способную не менее эффективно, чем химическое, уничтожать огромную массу людей.
В соответствии с предложенной Грамом систематикой, бактерии делятся на два типа:
- грамположительные, окрашиваемые в синий цвет смесью красителей кристаллического фиолетового с иодом (реактив Грама).
- грамотрицательные, не окрашиваемые реактивом Грама.
Грамотрицательные бактерии более устойчивы к бактерицидным препаратам, чем грамотрицательные, и для борьбы с ними необходим более сильнодействующий препарат.
Противомикробные препараты – это прежде всего сульфаниламиды. Их история начинается с 1935 года, когда впервые были проведены их испытания in vivo (внутри организма).
Сульфаниламиды обладают химиотерапевтической активностью при инфекциях, вызванных грамположительными и грамотрицательными бактериями.
Основной представитель – белый стрептоцид (парааминобензолсульфонамид).
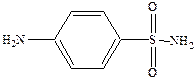
Его водорастворимая форма п‑сульфонамидфениламинометансульфонат натрия.
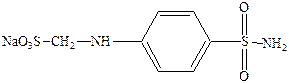
Белый стрептоцид имеет место быть в организме в результате метаболизма красного стрептоцида.
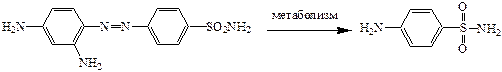
Но из-за токсичности красный стрептоцид снят с производства.
Механизм действия сульфаниламидов выяснен на уровне ферментов (досконально). Антибактериальная активность стрептоцида связана с ингибированием процесса синтеза дигидрофолиевой кислоты – важного фактора роста микроорганизмов. В этих процессах патогенные для человека бактерии используют в качестве строительного блока природный метаболит – п-аминобензойную кислоту.
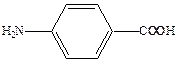
Пользуясь структурным сходством с п-аминобензойной кислотой, сульфаниламиды конкурентно включаются в процесс превращения пирофосфата в ложную дигидрофолиевую кислоту. Последняя не способна выполнить свою жизненную функцию и губительна для микроорганизмов. Дигидрофолиевая кислота под действием восстанавливающего фермента превращается в тетрагидрофолиевую кислоту, которая служит переносчиком углеродных фрагментов и играет важную роль в живых организмах как млекопитающих так и бактерий.
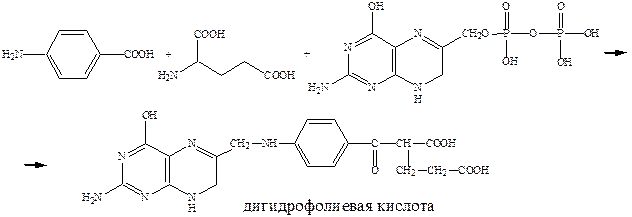
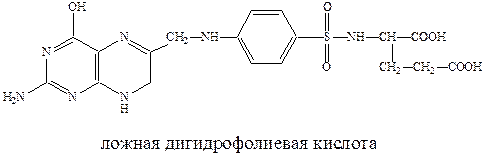
Для бактерий процесс синтеза дигидрофолиевой кислоты на основе п-аминобензойной кислоты является очень важным. Бактерии, в отличие от млекопитающих, могут получать этот продукт только в результате синтеза. А, например, люди к синтезу не способны и получают ее с пищей. Отсюда ингибирование этого синтеза приводит к гибели патогенных бактерий, не затрагивая жизненноважных функций организма млекопитающих.
Сульфаниламиды близки по структуре, электронным свойствам и размерам молекулы к п-аминобензойной кислоте. Вмешиваясь в синтез на стадии конденсации п-аминобензойной кислоты с глутаминовой кислотой и пиридиновым основанием сульфаниламиды нарушают синтез тимино- и пуриновых оснований, что ведет к быстрой гибели бактерий, лишенных возможности синтеза собственных ДНК.
Структурные аналоги метаболитов, подавляющие их биологические функции, называются антагонистами или антиметаболитами. Таким образом, антибактериальное действие сульфаниламидов обусловлены тем, что они являются антиметаболитами. Понятно, что многое решают дозы, в которых они используются, так как блокада ферментов является конкурентной и надо применять такие количества лекарственного препарата, которые исключат возможность использования микроорганизмами п-аминобензойной кислоты.
Недостаточные дозы или прерванный курс лечения приведут к выработке штаммов возбудителей резистентных (устойчивых) к сульфаниламидам.
Выявление физиологической активности синтезируемых структурных аналогов сульфаниламидов позволило дать заключение:
- Основная для проявления активности п-аминогруппа, она должна быть не защищенной (за исключением ацильной защиты
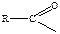 ).
). - Необходимо присутствие сульфамидной группы в ароматическом ядре.
- В ароматическом кольце должны быть замещены только пара‑положения.
- Азот-сульфамидные группы должны быть вторичными, и только радикал при нем может варьироваться.
Эти особенности выявлены в результате молекулярного дизайна.
Ряд сульфаниламидных препаратов получен за счет модификации сульфамидной группы, при этом имеет место наиболее целенаправленное действие. Так сульфацил натрий (альбуцид) широко применяется для лечения глазных болезней.
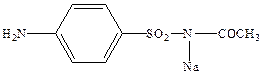
Ряд сульфамидных препаратов получен путем введения сульфамидную группу остатков гетероциклических оснований. К таким препаратам можно отнести сульфодиметоксин – лекарство длительного действия, и сульфален – сверхдлительного действия.
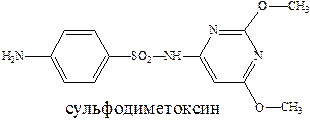
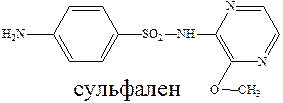
Введение дополнительных гетероциклических заместителей позволяет пролонгировать действие лекарственного препарата, улучшить проникновение их в жидкости и ткани организма и тем самым увеличить эффективность их действия.
Антибиотики
Антибиотики – продукты нормального обмена веществ любых живых организмов, способные убивать бактерии, грибы, вирусы. Их открытие связано с именем английского ученого Флеминга, впервые обнаружившего противомикробную активность зеленой плесени в 1928 году. А выделение действующего начала зеленой плесени (натриевой соли пенициллина) осуществил английский ученый Флори в 1940 году. Введение в медицинскую практику антибиотиков позволило эффективно лечить пневмонию, менингит, сепсис, ангину, кишечные инфекции, холеру, дизентерию, туберкулез и др.
Антибиотики имеют различное химическое строение.
Первая группа антибиотиков – β‑лактамные (пенициллины), эффективны при инфекциях вызванных грамположительными бактериями (стрептококки, стафилококки, пневмококки). Пенициллины оказывают выраженный эффект в отношении растущих микроорганизмов (бактерицидное действие). Они поражают бактерии в фазе роста, ослабляя их клеточные стенки, а учитывая, что для бактерий характерно необыкновенно высокое внутреннее давление, это приводит к разрыву клеточной стенки и уничтожению бактерии. Активность препаратов пенициллина определяют по антибактериальному действию на определенный штамм золотистого стафилококка. За единицу действия принимают активность 0,5988 г химически чистой кристаллической натриевой соли бензилпенициллина.
Результат скрининга «структура‑свойства» для пенициллина сводится к следующему:
- Обязателен лактамный цикл (внутренний амид).
- Обязательно наличие свободной карбоксильной группы
- Важна бициклическая система.
- Важна ациламинная связь.
- Часто сера необязательна.
- Цис-стереохимия обязательна в бициклической системе.
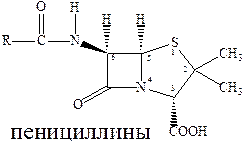
Серьезной проблемой, стоящей на пути использования пенициллина, кроме их малой кислотоустойчивости, является и возникновение резистентности – для пенициллинов это общая проблема, касающаяся и многих других препаратов. Например, микробактерии туберкулеза обладают природной резистентностью к пенициллину, а многие штаммы стафилококка, чувствительные к действию антибиотиков, достаточно легко приобретают резистентность к ним.
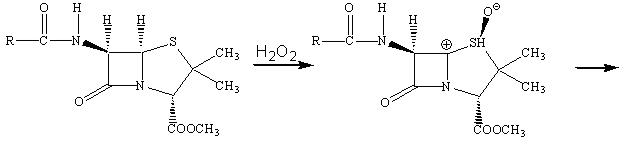
Важным механизмом такой резистентности микроорганизмов по отношению к β‑лактамным антибиотикам является образование бактериями ферментов – β‑лактамаз, которые раскрывают β‑лактамные циклыи тем самым лишают эти антибиотики возможности выступать в качестве ацилирующего агента, что и является основой их биологического действия. При этом пенициллин превращается в неактивное производное пенициллиновой кислоты.
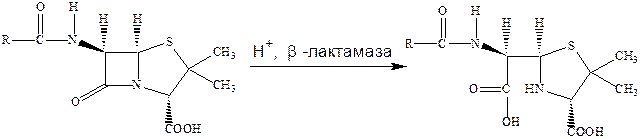
Главный путь борьбы с этим явлением – поиск соединений, способных ингибировать эти ферменты и предотвращать инактивацию антибиотиков. Было установлено, что таким эффективным ингибитором β‑лактамаз является клавулановая кислота.
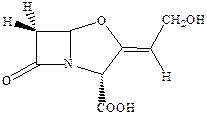
Сама по себе она не обладает антибактериальной активностью и применяется только с β‑лактамными антибиотиками. Интересно, что пенициллины являются синергистами стрептомицина (противотуберкулезный лекарственный препарат, относящийся к аминогликозидам).
Синергизм – одновременное комбинированное воздействие двух (или более) факторов, характеризующихся тем, что такое совместное действие значительно превосходит эффект каждого отдельно взятого компонента.
Скелет молекулы пенициллина наводит на мысль о том, что пенициллин состоит из аминокислот цистеина и валина, это может быть установлено с помощью меченых атомов. Пенициллин ингибирует синтез клеточной стенки, ослабляет мембрану бактериальной клетки и облегчает доступ стрептомицина не только к внеклеточным, но и внутриклеточным микобактериям туберкулеза.
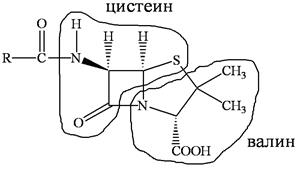
У пенициллинов есть и минусы. Их отличает узкий спектр действия, и, что более существенно, они не подавляют грамотрицательные бактерии.
Учитывая, что пенициллин способен вызывать аллергическую реакцию организма, вполне понятны попытки синтеза аналогов, не обладающих аллергической реакцией. Сюда входит группа цефалоспоринов во многом сходных структурно с пенициллином. Они также содержат β‑лактамное кольцо, но здесь оно аннелировано (аннелирование – процесс пристраивания карбоцикла или гетероцикла к уже существующему в исходной молекуле циклическому фрагменту) не с тиазолидиновым, а с 3,4‑дигидро‑1,3‑тиозиновым циклом.
Цефалоспорины также проявляют бактерицидную активность за счет блокады D‑аланин‑узнающей полимеразы, ответственной за синтез новой клеточной оболочки бактерий. Пенициллины – антагонисты D‑аланил‑D‑аланинов. Главная особенность цефалоспоринов по сравнению с пенициллинами большая устойчивость первых по отношению к β‑лактамазам. Цефалоспорины обладают более широким спектром действия, включая влияние на грамотрицательные микроорганизмы.
Американская фирма Lilly впервые продемонстрировала синтез лекарства, в котором пятичленное тиазолидиновое кольцо пенициллина превращается в шестичленное дигидротиозиновое кольцо цефалоспорина.
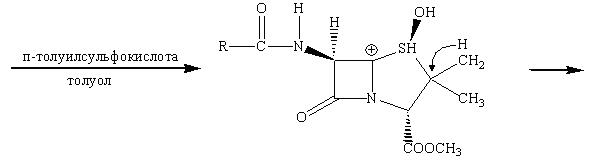
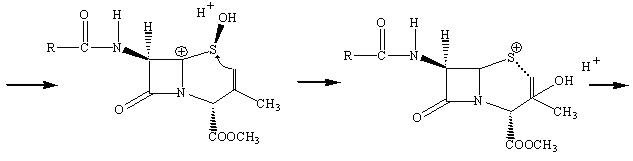
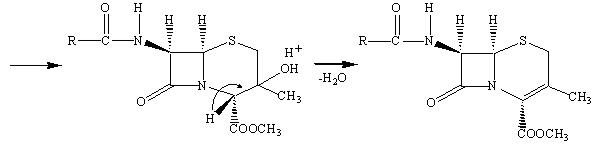
Наличие метильной группы в положении 3 для ряда цефалоспоринов обычно плохо сказывается на их активности, но значительно облегчает всасывание этих препаратов кишечником.
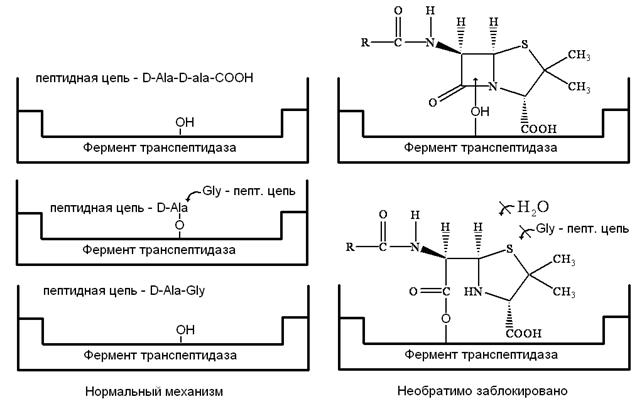
Рассмотрим механизм действия β‑лактамных антибиотиков. Как мы уже отмечали, для бактериальных клеток характерно необыкновенно высокое внутреннее осмотическое давление. От разрыва их удерживает стенка, прочность которой придает пептидогликал. В молекуле пептидогликала концевой всегда является пара D‑аланил‑D‑аланин (D‑Ala‑D‑Ala). Было предположено, что конформация пенициллина подобна таковой, если взять часть сложной аминокислотной цепочки D‑аланил‑D‑аланина при ее поперечном связывании пока это есть реакционный центр для фермента (т.е. мишень). Транспептидаза ошибочно допускает молекулу пенициллина вместо D‑аланил‑D‑аланина в активный сайт и реакция в активном сайте протекает уже с ним. В нормальном механизме амидная связь между двумя аланиновыми звеньями пептидной цепи расщепляется, и последнее звено аланина уходит из пептидной цепи в активном сайте. В пентаглицине последний фрагмент глицина может вступить в сайт и образовать пептидную связь с фрагментом аланина и таким образом удалиться из активного сайта.
Фермент может атаковать β‑лактамное кольцо пенициллина и открыть его также, как он делает это с амидной связью пептида. Поскольку пенициллин имеет циклическое строение, он не расщепляется на две части и не покидает активный сайт. Последующий гидролиз ацильной группы не происходит, т.к. глицин не способен вытащить из сайта объемную молекулу пенициллина.
Дата добавления: 2019-02-07; просмотров: 539;
