Основные сведения, связанные с описанием химически и термодинамически неравновесных систем
Если внешние условия меняются достаточно быстро, то в системе не успевает установиться химическое равновесие. В этом случае скорости прямой и обратной реакций не равны и их нужно рассматривать совместно.
Например, для реакции диссоциации молекулярного кислорода 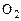
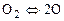 (1.5.1)
(1.5.1)
в неравновесной системе при определении состава смеси следует учитывать скорости как прямой:
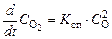 , (1.5.2)
, (1.5.2)
так и обратной реакций:
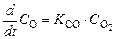 , (1.5.3)
, (1.5.3)
где коэффициенты пропорциональности 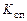 и
и 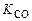 , зависящие от температуры смеси, называются соответственно константами скоростей прямой и обратной реакций.
, зависящие от температуры смеси, называются соответственно константами скоростей прямой и обратной реакций.
Уравнения для скоростей химических реакций называются уравнениями кинетики.
С течением времени скорости прямой и обратной реакций уравниваются и при переходе к состоянию равновесия выполняется условие
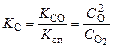 . (1.5.4)
. (1.5.4)
Отличительная особенность расчета химически неравновесных процессов состоит в том, что скорость образования отдельных компонентов зависит от стадий химических превращений, в которых участвуют эти компоненты. Это означает, что, определяя текущий состав смеси, следует учитывать все химические реакции, которые в ней могут проходить. Наиболее полная информация по составу в каждой точке турбулентной струи, температурам, скоростям и прочим газодинамическим параметрам выдается при непосредственном расчете турбулентной струи с учетом уравнений кинетики. Методы совместного решения стационарных двумерных уравнений пограничного слоя с уравнениями кинетики разработаны достаточно хорошо. Однако практическая реализация расчета химически неравновесных турбулентных струй ограничена, главным образом, отсутствием надежных данных по скоростям химических реакций. Например, приведем результаты расчета скоростей реакции горения СО(это основное химическое соединение в составе продуктов сгорания большинства топлив, догорающее в атмосфере) при Т=2100 K, 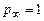 ата, в предварительно подготовленной смеси СО с воздухом (содержание СОпо объему – 40%) по различным методикам:
ата, в предварительно подготовленной смеси СО с воздухом (содержание СОпо объему – 40%) по различным методикам:
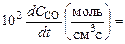 5.7; 4.1; 0.001; 0.26; 8.9; 1.7.
5.7; 4.1; 0.001; 0.26; 8.9; 1.7.
Экзотермические и эндотермические реакции. Химические реакции обычно происходят с выделением или поглощением тепла.
Реакции, сопровождающиеся выделением тепла, называются экзотермическими. Примеры экзотермических реакций:
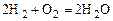 , (1.5.5)
, (1.5.5)
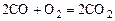 . (1.5.6)
. (1.5.6)
Реакции, сопровождающиеся поглощением тепла, называются эндотермическими. Примером эндотермической реакции является реакция диссоциации 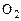 :
:
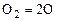 , (1.5.7)
, (1.5.7)
а также реакции, обратные приведенным в соотношениях (1.5.5), (1.5.6).
Влияние температуры на скорость реакции. Запишем в общем виде выражение для скорости прямой реакции 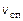 :
:
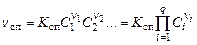 , (1.5.8)
, (1.5.8)
где 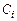 – объемно-мольная концентрация,
– объемно-мольная концентрация, 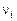 – число молей i-го газа, вступающего в реакцию.
– число молей i-го газа, вступающего в реакцию.
Все рассуждения и выводы, приведенные далее, будут справедливы и для обратной реакции. Поэтому ограничимся анализом лишь прямой реакции.
В соотношение (1.5.8) входит константа скорости прямой реакции 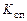 . Расчеты и опытные данные показывают, что значение
. Расчеты и опытные данные показывают, что значение 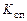 , а, следовательно, и скорость реакции при увеличении температуры растут очень быстро.
, а, следовательно, и скорость реакции при увеличении температуры растут очень быстро.
Установим зависимость между значениями 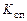 и T на базе молекулярно-кинетической теории.
и T на базе молекулярно-кинетической теории.
Основным условием для прохождения реакции является столкновение молекул газа, участвующих в ней. По этому скорость реакции будет тем больше, чем чаще сталкиваются молекулы, а следовательно, чем больше будут концентрации реагирующих веществ. Однако далеко не каждое столкновение молекул заканчивается их соединением и образованием новых компонентов. Это связано с тем, что энергия сталкивающихся молекул должна быть достаточной для разрушения старых химических связей и образования новых.
Тот минимум энергии, который необходим для обеспечения химического взаимодействия сталкивающихся молекул, называется энергией активации. Обозначим ее буквой А.
При увеличении температуры увеличиваются скорость хаотического теплового движения молекул и их кинетическая энергия, что влечет за собой увеличение числа столкновений активных молекул и, следовательно, скорости химической реакции.
Согласно кинетической теории газа число столкновений, энергия которых превышает энергию активации, будет равно:
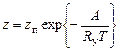 , (1.5.9)
, (1.5.9)
где z –число столкновений, энергия которых превышает А;
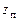 – полное число столкновений. В соответствии с этим зависимость константы скорости реакции
– полное число столкновений. В соответствии с этим зависимость константы скорости реакции 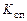 от температуры будет иметь вид
от температуры будет иметь вид
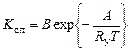 , (1.5.10)
, (1.5.10)
где В – константа скорости, соответствующая полному числу столкновений.
Вследствие сильной зависимости скорости реакции от температуры многие из них (например, соединение 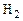 и
и 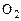 ) при низких температурах протекают столь медленно, что состав смеси остается неизменным или, как это принято говорить, «замороженным». При высоких температурах эти же реакции, наоборот, осуществляются со столь большими скоростями, практически бесконечно большими, что смесь мгновенно переходит в равновесное состояние.
) при низких температурах протекают столь медленно, что состав смеси остается неизменным или, как это принято говорить, «замороженным». При высоких температурах эти же реакции, наоборот, осуществляются со столь большими скоростями, практически бесконечно большими, что смесь мгновенно переходит в равновесное состояние.
Если реакция между компонентами, составляющими смесь, экзотермическая, то с увеличением температуры и, соответственно, скорости увеличивается количество тепла, выделяющегося в реакции. Это в свою очередь приведет к дальнейшему росту температуры. Процесс становится лавинообразным. Смесь воспламеняется и сгорает.
Температура, при которой количество выделяющейся при реакции теплоты начинает превышать тепловые потери, что приводит к быстрому увеличению температуры, называется температурой воспламенения.
Смесь некоторых газов способна самовоспламеняться на воздухе при обыкновенной температуре.
Проведенный анализ позволяет предположить, что турбулентные струи, в которых возможно протекание экзотермических реакций при смешении с окружающим воздухом, будут либо «замороженными», либо равновесными.
Помимо химической возможна и термодинамическая неравновесность. Например, в плазме электроны, имеющие значительно меньшую массу по сравнению с ионами, быстрее реагируют на изменение внешних условий. Поэтому температура электронов при термодинамической неравновесности может существенно отличаться от температуры ионов.
Дата добавления: 2018-11-25; просмотров: 411;
