Определение равновесного состава и термодинамических характеристик смеси газов при заданных давлении и температуре
Определение состава и термодинамических характеристик равновесной смеси при заданных условной формуле смеси, давлении р и температуре T проводится при следующих основных допущениях:
· смесь реагирующих газов является равновесной;
· статическое давление смеси равняется, по закону Дальтона, сумме парциальных давлений газообразных компонентов;
· уравнение состояния для идеального газа справедливо как для отдельных газообразных компонентов, так и для смеси в целом;
· константы равновесия реакций зависят только от температуры;
· объем, занимаемый твердой фазой, пренебрежимо мал по сравнению с объемом, занимаемым газообразными продуктами;
· температуры твердой и газовой фаз равны. Парциальное давление газовой фазы равно давлению насыщенного пара для данного конденсированного химического соединения.
В соответствии с законом, установленным в 1840 г. русским академиком Г.Г. Гессом, тепловой эффект реакции не зависит от пути реакции при сохранении постоянными начальных и конечных условий. Это позволяет цепочку химических реакций, приводящих к образованию конечных компонентов, выбирать произвольно, исходя из удобства разработки алгоритма расчета.
В большинстве существующих программ термодинамических расчетов используется система реакций диссоциации конечных компонентов на атомы.
Тогда полная система уравнений для определения равновесного состава запишется в следующем виде.
Уравнение диссоциации всех ожидаемых молекулярных компонентов 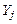 на атомы
на атомы 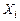 :
:
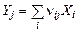 , (1.6.1)
, (1.6.1)
где 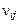 – число атомов i-го химического элемента в компоненте j.
– число атомов i-го химического элемента в компоненте j.
Закон действующих масс для неконденсированных веществ:
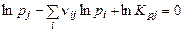 , (1.6.2)
, (1.6.2)
где 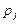 и
и 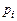 – парциальные давления молекулярных и атомарных компонентов, а
– парциальные давления молекулярных и атомарных компонентов, а 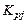 – зависящая от температуры константа равновесия j-й реакции.
– зависящая от температуры константа равновесия j-й реакции.
Закон действующих масс для газовой фазы конденсированных веществ:
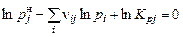 , (1.6.3)
, (1.6.3)
где 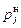 – давление насыщенного пара для данного конденсированного химического соединения. При фиксированной температуре величины
– давление насыщенного пара для данного конденсированного химического соединения. При фиксированной температуре величины 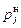 известны.
известны.
Уравнения сохранения вещества, представляющие собой условия постоянства количества молей i-го химического элемента в процессе реакции:
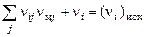 , (1.6.4)
, (1.6.4)
где 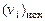 – число молей i-го химического элемента в исходных продуктах, а
– число молей i-го химического элемента в исходных продуктах, а 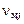 и
и 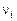 – числа молей молекулярных и атомарных компонентов. По закону Авогадро моли различных идеальных газов при одинаковых условиях занимают одинаковый объем. Это позволяет связать
– числа молей молекулярных и атомарных компонентов. По закону Авогадро моли различных идеальных газов при одинаковых условиях занимают одинаковый объем. Это позволяет связать 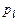 и
и 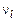 соотношениями вида (см. (1.2.10) и (1.2.30)):
соотношениями вида (см. (1.2.10) и (1.2.30)):
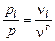 , (1.6.5)
, (1.6.5)
где 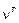 – общее число молей газа,
– общее число молей газа, 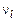 – число молей l-го компонента газовой смеси,
– число молей l-го компонента газовой смеси, 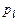 – парциальное давление l-го компонента.
– парциальное давление l-го компонента.
Закон Дальтона для газообразных компонентов:
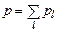 . (1.6.6)
. (1.6.6)
Общее количество молей конденсированного вещества 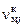 складывается из числа молей в газовой
складывается из числа молей в газовой 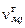 и твердой
и твердой 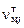 фазах:
фазах:
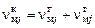 . (1.6.7)
. (1.6.7)
Аналогично для конденсированных элементов
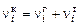 . (1.6.8)
. (1.6.8)
Число молей i-го химического элемента в исходных продуктах выражается через условную формулу смеси 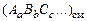 и массу т в кг :
и массу т в кг :
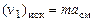 ,
, 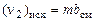 и т.д. (1.6.9)
и т.д. (1.6.9)
Если обозначить через 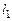 – число газообразных веществ,
– число газообразных веществ, 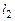 – число газообразных элементов,
– число газообразных элементов, 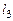 – число конденсированных веществ,
– число конденсированных веществ, 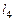 – число конденсированных элементов, то можно написать
– число конденсированных элементов, то можно написать 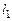 уравнений (1.6.2),
уравнений (1.6.2), 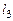 – (1.6.3),
– (1.6.3), 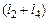 – (1.6.4),
– (1.6.4), 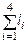 – (1.6.5),
– (1.6.5), 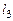 – (1.6.7),
– (1.6.7), 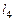 – (1.6.8). В результате будем иметь замкнутую систему (1.6.2) – (1.6.9) для определения т, парциальных давлений газообразных продуктов и молярного состава смеси. Массовые доли выражаются через молярный состав (см. (1.2.11)):
– (1.6.8). В результате будем иметь замкнутую систему (1.6.2) – (1.6.9) для определения т, парциальных давлений газообразных продуктов и молярного состава смеси. Массовые доли выражаются через молярный состав (см. (1.2.11)):
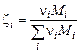 . (1.6.10)
. (1.6.10)
Если в смеси имеют место процессы ионизации, то система (1.6.2) – (1.6.9) дополняется уравнениями, выражающими закон действующих масс применительно к ионизации, которые формально могут быть записаны в форме (1.6.2), и условием сохранения заряда системы.
Система (1.6.2) – (1.6.9) решается численно методом последовательных приближений.
Рассмотренный выше порядок нахождения равновесного состава обладает универсальностью, так как введение нового химического соединения добавляет к системе (1.6.1) лишь одну реакцию диссоциации этого соединения на атомы. Однако для конкретных исходных веществ могут быть построены более простые и наглядные, но, естественно, менее универсальные схемы расчета равновесного состава.
В уравнениях, описывающих процесс развития турбулентной струи, применяются такие термодинамические величины: 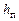 – теплосодержание (энтальпия), R – газовая постоянная,
– теплосодержание (энтальпия), R – газовая постоянная, 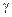 – показатель адиабаты. Эти параметры определяются по соотношениям (1.2.40) – (1.2.46).
– показатель адиабаты. Эти параметры определяются по соотношениям (1.2.40) – (1.2.46).
Дата добавления: 2018-11-25; просмотров: 583;
