ЗАКОНЫ ГАЗОВОГО СОСТОЯНИЯ
Закон Авогадро:в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул.
Это означает, что одно и то же число молекул любого газа занимает при одинаковых физических условиях один и тот же объем. Из закона Авогадро следует, что:
1. При условии Р,Т = const 1 моль любого газа занимает один и тот же объем VM, который называют молярным объемом. При нормальных условиях (н.у.) – давление 101,325 кПа (1 атм. или 760 мм рт. ст.), температура 273 К ( 0 °С) – этот объем V 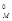 = 22,4 дм3/моль;
= 22,4 дм3/моль;
2. Отношение масс равных объемов различных газов равно отношению их молярных масс
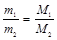 ,
,
где m1, m2 – массы газов, г; M1, M2 – молярные массы газов, г/моль. Отношение 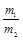 получило название относительной плотности первого газа по второму D
получило название относительной плотности первого газа по второму D 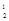 . Тогда
. Тогда
M1 = M2 × D 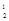 .
.
Зависимость между количеством идеального газа, его объемом, давлением и температурой можно выразить равенством, которое носит название уравнение Менделеева-Клапейрона
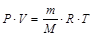 ,
,
где 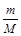 = n, моль; P – давление, Па; V – объем газа, м3; R = 8,314
= n, моль; P – давление, Па; V – объем газа, м3; R = 8,314 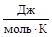 - универсальная газовая постоянная; T – температура, К.
- универсальная газовая постоянная; T – температура, К.
Если газообразная фаза представляет собой смесь нескольких газов, то по закону парциальных давлений, общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь:
Р = Р1 + Р2 + Р3 + … ,
где Р – общее давление; Р1, Р2, Р3 … - парциальные давления газов 1, 2, 3 … .
Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. То есть, парциальное давление i –того газа в смеси Рi можно вычислить по уравнению
Рi = 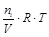 ,
,
где ni – число моль i –того газа в смеси.
Парциальное давление газа в смеси можно вычислить через общее давление смеси, используя мольную долю, по формуле
Pi = xi × P,
где xi 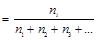 - мольная доля i –того газа в смеси.
- мольная доля i –того газа в смеси.
Пример 1.Вычислите плотность этана по водороду и воздуху.
Р е ш е н и е
Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс этих газов, то есть:
1. Плотность этана С2Н6 по водороду Н2 равна
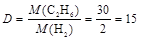 .
.
2. Плотность этана С2Н6 по воздуху равна
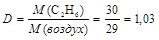 .
.
Пример 2.При 273 К в сосуде объемом 14 дм3 содержится 8 г водорода и 6,3×10-3 кг азота. Определите парциальное давление каждого газа и общее давление смеси.
Р е ш е н и е
1. Найдем количество вещества для каждого газа как отношение массы газа к его молярной массе
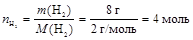 ;
; 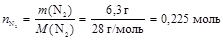 .
.
2. Вычисляем парциальное давление каждого газа
РН2 = 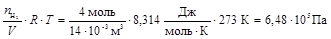 ,
,
РN2 = 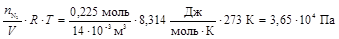 .
.
3. Тогда общее давление смеси газов найдем как сумму парциальных давлений газов, составляющих смесь
Р = РН2 + РN2 = 6,48×105 + 3,65×104 = 6,845×105 Па.
Пример 3.Какой объем займет смесь газов, содержащая 14 г азота, 32 г кислорода и 35,5 г хлора, при нормальных условиях и в условиях, когда температуру повысят на 20 К, а давление увеличат на 0,5 атм.?
Р е ш е н и е
1. Определим общее число моль газов в смеси
n = n(N2) + n(O2) + n(Cl2) =
= 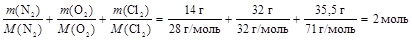 .
.
2. Найдем объем смеси газов при н.у., используя понятие V 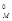 = 22,4 дм3/моль
= 22,4 дм3/моль
V° = n× V 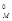 = 2 × 22,4 = 44,8 дм3 .
= 2 × 22,4 = 44,8 дм3 .
3. Найдем объем смеси газов в условиях
Т = 273 + 20 = 293 К; Р = 1 + 0,5 = 1,5 атм. = 1,5× 101325 = 151987,5 Па ,
используя уравнение Менделеева-Клапейрона
V = 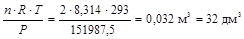 .
.
З А Д А Ч И
1. Относительная плотность паров брома по воздуху равна 5,5. Определите молярную массу паров брома и запишите химическую формулу.
2. Шар объемом 5 дм3 при давлении 105 Па и температуре 27 °С поднят в верхние слои атмосферы, где давление составляет 103 Па, а температура ниже на 50°. Вычислите объем шара в новых условиях, если шар имеет легко растяжимую оболочку.
3. При 27 °С и 1 атм. масса газообразного вещества объемом 1,5 дм3 составляет 4,755 г. Определите молярную массу вещества и его количество в моль.
4. В автомобильной шине объемом 0,5 м3 воздух находится под давлением 1,8×105 Па. Сколько воздуха (в кг) находится в шине при температуре 10 °С?
5. Определите давление в сосуде объемом 5,6 дм3 при 298 К, содержащем 0,5 г водорода, 18,25 г хлороводорода и 35,5 г хлора.
6. Какова молярная масса газа, если 9,6 г данного газа занимает объем 2,52 дм3 при 300 К и давлении 121,59 кПа.
7. Определите давление оксида серы (IV) массой 16 г в сосуде вместимостью 24,5 дм3 при 298 К.
8. Сколько молекул содержится в смеси, содержащей хлор объемом 11,2 дм3 и водород объемом 22,4 дм3 при нормальных условиях?
9. Вычислите давление, при котором 2 г кислорода при температуре 0°С займет объем 1 дм3.
10. До какой температуры должен быть нагрет 1 г азота, чтобы при давлении 1,5 атм. он занимал объем 5 дм3?
11. Какой объем при нормальных условиях займет смесь газов, состоящая из 3,5 г азота, 640 г кислорода и 70 г оксида углерода (II)?
12. В одном из баллонов находится азот, а в другом кислород. Массы обоих газов одинаковы. В каком баллоне и во сколько раз больше давление при 27 °С?
13. Определите давление кислорода, если 0,1 кг этого газа находится в сосуде объемом 0,02 м3 при 20 0С.
14. 0,2.10-3 м3 водорода собраны над водой при 33 0С и давлении 96000 Па. Определите объем сухого водорода (н.у.). Упругость насыщенного водяного пара при 33 0С равна 5212 Па.
15. В закрытом сосуде объемом 6.10-3 м3 при 10 0С находится смесь, состоящая из 8,8.10-3 кг диоксида углерода; 3,2.10-3 кг кислорода и 1,2.10-3 кг метана. Вычислите общее давление газовой смеси и парциальное давление газов.
16. При н.у. масса 0,5.10-3 м3 газа равна 1,806.10-3 кг. Определите плотность газа по диоксиду углерода СО2 и метану CH4, а так же молекулярную массу газа.
17. Каково давление в сосуде ёмкостью 11,2 дм3 содержащем 42 г N2 и 8 г CH4.
18. Определите массу паров толуола С7Н8 в помещении объёмом 30 м3 при 25 0С. Давление паров толуола при этой температуре равно 2972 Па.
19. Объем резиновой камеры автомобильной шины равен 0,025 м3, давление в ней 5,0665.105 Па. Определите массу воздуха, находящегося в камере, при 20 0С.
20. При 17 0С и давлении 1,040.105 Па масса 0,624.10-3 м3 газа равна 1,56.10-1 кг. Определите молекулярную массу газа.
21. В газонаполненных лампах содержится смесь газов, имеющая объемный состав: 86 % мас. Ar и 14 % мас. N2. Рассчитайте парциальное давление каждого из газов, если общее давление равно 39990 Па.
22. Определите массу 10-3 м3 газовой смеси, содержащей (по объему) 50% водорода и 50% диоксида углерода (н.у.).
23. При нормальных условиях 1 г воздуха занимает объем 773 см3. Какой объем займет та же масса воздуха при 0 0С и давлении, равном 93,3 кПа?
24. Масса колбы вместимостью 750 см3, наполненной при 27 0С кислородом равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определите давление кислорода.
25. 250 см3 водорода собрали над водой при 26 0С и давлении 98,7 кПа. Давление насыщенного пара воды при 26 0С составляет 3,4 кПа. Вычислите массу водорода и его объем при н.у.
26. Смешали 0,04 м3 азота, находящегося под давлением 96 кПа, с 0,02 м3 кислорода. Общий объем смеси 0,06 м3, а общее давление 97,6 кПа. Каким было давление взятого кислорода?
27. В 0,1 м3 воздуха содержится 6.10-3 м3 ксенона. В каком объеме воздуха (н.у.) содержится 1025 молекул ксенона?
28. Масса 87.10-6 м3 пара при 62 0С и давлении 1,01.105 Па равна 0,24.10‑3 кг. Вычислите массу вещества и массу одной молекулы вещества.
29. Массовая доля фосфора в одном из его оксидов равна 56,4 %. Плотность паров этого вещества по воздуху равна 7,6. Установите молекулярную формулу оксида.
30. Относительная плотность газа по воздуху равна 1,517. Рассчитайте количество вещества этого газа, которое заключается в его образце массой 11 г.
Дата добавления: 2018-11-25; просмотров: 1850;
