МОЛЬ. МОЛЯРНАЯ МАССА
Истинные массы атомов и молекул очень малы, порядка 10-24¸10-20 г. Пользоваться столь малыми величинами неудобно. Поэтому в химии имеют дело не с абсолютными значениями масс, а с относительными атомными и молекулярными массами.
Относительной атомной массой химического элемента Аr называется величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к 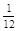 массы изотопа углерода 12 (12С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
массы изотопа углерода 12 (12С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
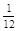 массы изотопа углерода
массы изотопа углерода 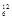 С принята за атомную единицу массы (а.е.м.).
С принята за атомную единицу массы (а.е.м.).
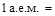
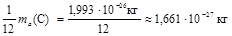 .
.
Относительной молекулярной массой вещества Mr называется отношение массы его молекулы к 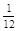 массы изотопа углерода 12.
массы изотопа углерода 12.
Связь между Mr и истинной массой вещества m в кг выражается формулами
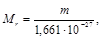
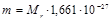 .
.
В 1971 году в Международную систему единиц измерения (СИ) была введена единица количества вещества – моль. Моль – количество вещества, содержащее столько структурных элементарных частиц (атомов, молекул, ионов, электронов, эквивалентов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12. Число атомов в 0,012 кг углерода равно 6,02×1023 атомов. Эта величина называется постоянной Авогадро NА и является одной из важнейших универсальных постоянных
NА = (6,022045±0,000031)×1023 моль-1.
Масса 1 моль вещества называется молярной массой M и представляет собой отношение массы вещества m к его количеству n, кг/моль (или г/моль):
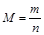 .
.
Численное значение молярной массы в г/моль совпадает с относительной молекулярной или атомной массой данного вещества.
Пример 1.Сколько молекул СО получится при сгорании 4 мг углерода?
Р е ш е н и е
1. Составим уравнение реакции горения углерода с образованием СО
2С + О2 = 2СО ,
из которого следует, что при сгорании 1 моль углерода образуется 1 моль газа СО.
2. Найдем количество моль углерода, которое будет равно числу моль СО
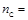
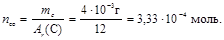
3. Тогда число молекул оксида углерода (II) найдем по формуле
 NСО = nCO×NA = 3,33×10-4×6,02×1023 = 2,00×1020 .
NСО = nCO×NA = 3,33×10-4×6,02×1023 = 2,00×1020 .
Пример 2. Определите абсолютную массу молекулы серной кислоты в граммах.
Р е ш е н и е
1. Найдем относительную молекулярную массу молекулы H2SO4
Mr = 2×Ar(H) + Ar(S) + 4× Ar(O) = 2×1 + 32 + 4×16 = 98 а.е.м.
2. Так как Mr и масса 1 моль вещества численно равны друг другу, то
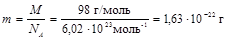 .
. 
Пример 3.Сколько моль атомов азота содержится в 1 кг нитрата аммония?
Р е ш е н и е
1. Масса 1 моль нитрата аммония NH4NO3 равна
М = 2×Ar(N) + 4× Ar(H) + 3× Ar(O) = 2×14 + 4×1 + 3×16 = 80 г/моль.
2. Из формулы вещества следует, что 1 моль нитрата аммония содержит 2 моль атомов азота, тогда
nN = 2nнитрата = 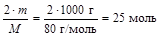 .
.
Пример 4.Массовая доля фосфора в его оксиде равна 43,7 % мас. Определите простейшую формулу оксида.
Р е ш е н и е
Обозначим числа атомов фосфора и кислорода в простейшей формуле оксида через х и у. Атомные массы данных элементов равны 31 и 16. Значит, массы фосфора и кислорода в составе оксида относятся друг к другу как 31х :16у. По условию задачи в 100 г оксида содержится 43,7 г фосфора и 56,3 г кислорода. Следовательно
31х :16у = 43,7: 56,3 или х : у = 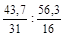 = 1,41 : 3,52 .
= 1,41 : 3,52 .
Чтобы выразить полученное соотношение целыми числами, необходимо оба значения поделить на наименьшее из них
х : у = 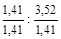 = 1 : 2,5 .
= 1 : 2,5 .
Поскольку дробные коэффициенты в химических формулах не употребляются, то оба члена последнего соотношения умножим на два
х : у = 2 : 5 .
Таким образом, простейшая формула оксида фосфора Р2О5 .
З А Д А Ч И
1. Молекула некоторого вещества имеет массу, равную 1,2×10-25 кг. Определите молекулярную массу вещества.
2. Сколько молекул СО2 получится при сгорании 2 г углерода?
3. Если отсчитывать по 60 молекул в 1 минуту, то сколько лет потребуется для того, чтобы пересчитать то количество молекул, которое содержит 1 кг йода (год считать равным 365 дням)?
4. Сравните число молекул, содержащееся в 4 кг соляной кислоты, с числом молекул, содержащимся в 4 кг азотной кислоты. В каком случае и во сколько раз число молекул больше?
5. Выразите в молях 6,02×1022 молекул ацетилена. Какова молярная масса этого соединения?
6. В какой массе аммиака содержится столько же молекул, сколько содержится молекул в 1 кг хлора?
7. Сколько грамм СО необходимо сжечь, чтобы получить столько же молекул СО2, сколько их содержит 10 г водорода?
8. Сколько моль кислорода образуется при разложении 490 г KСlO3?
9. Сколько грамм цинка и серной кислоты необходимо взять, чтобы получить 4 моль водорода?
10. В каком количестве хлорида натрия содержится столько же натрия, сколько его находится в 5 моль сульфата натрия?
11. В какой массе хлорида натрия содержится столько же натрия, сколько его находится в 2 моль нитрита натрия?
12. Сколько грамм серы содержится в 0,5 моль сульфата железа (II)?
13. Сколько грамм кислорода потребуется для окисления 0,25 моль алюминия?
14. Сколько грамм СО потребуется для полного восстановления 3,42×1026 молекул оксида железа (III)?
15. Сколько молекул сульфида цинка может образоваться из смеси, в состав которой входят 130 г цинка и 48 г серы?
16. Исходя из молярной массы углерода, определите абсолютную массу атома углерода в граммах.
17. Вычислите, сколько азота в граммах содержится в 1 кг нитрата калия.
18. Исходя из молярной массы воды, определите абсолютную массу молекулы воды в граммах. Сколько молекул воды может образоваться при разложении 1 г пероксида водорода?
19. Вычислите, сколько азота содержится в 1 кг дигидрофосфата аммония. Определите весовое соотношение между водородом и азотом.
20. Вычислите, сколько моль азотной кислоты потребуется для получения 1 кг нитрата кальция.
21. Напишите уравнение реакции гидроксида железа (III) с соляной кислотой, при которой образуется хлорид дигидроксожелеза. Сколько грамм гидроксида и кислоты необходимо для получения 0,1 моль данной соли?
22. Сравните число молекул, содержащееся в 1 кг перманганата калия, с числом атомов кислорода, содержащимся в 100 г азотной кислоты. В каком случае и во сколько раз число частиц больше?
23. Сколько атомов кислорода расходуется при сжигании 2 моль магния?
24. Сколько грамм оксида ртути (II) потребуется для получения такого количества кислорода, которое понадобится для окисления 7 г хлора с образованием его высшего оксида?
25. Определите весовое соотношение (в % мас.) между азотом и кислородом в гидросульфите аммония.
26. Кристаллогидрат содержит 18,6 % мас. натрия, 25,8 % мас. серы, 19,4 % мас. кислорода и 36,2 % мас. воды. Выведите формулу кристаллогидрата, зная, что его молекулярная масса равна 248 г/моль.
27. Определите простейшую формулу щавелевой кислоты, если известно, что в 20 г этой кислоты содержится 0,444 г водорода, 5,33 г углерода, остальное – кислород.
28. Установите формулу кристаллогидрата сульфата железа (II), если известно, что эта соль содержит 45,32 % воды по массе.
29. Сколько моль сульфида железа (II) получится при нагревании 7 г железа с 7 г серы? Какое вещество израсходуется полностью?
30. Сколько грамм кислорода требуется для окисления:
а) 1 моль алюминия; б) 35 г цинка; в) 3,01×1023 атомов магния?
Дата добавления: 2018-11-25; просмотров: 1610;
