Вычислим МЭ(О), зная что степень окисления кислорода в оксиде равна –2
МЭ(О) = 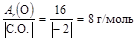 .
.
Тогда
МЭ(Ме) = 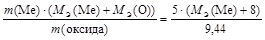 или МЭ(Ме) = 9 г/моль.
или МЭ(Ме) = 9 г/моль.
Относительную атомную массу металла найдем по формуле
Аr(Ме) = МЭ(Ме)×В = 9 × 3 = 27.
Пример 2. Мышьяк образует оксид, содержащий 65,2 % мас. мышьяка. Вычислите молярную эквивалентную массу мышьяка и определите простейшую формулу оксида.
Р е ш е н и е
1. Оксид мышьяка состоит из элементов As и О. Тогда закон эквивалентов можно записать так
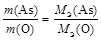 .
.
Отношение масс элементов в оксиде равно отношению массовых долей (% мас.) этих элементов, то есть
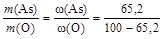 .
.
Тогда МЭ(As) = 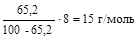 .
.
2. Для того чтобы записать химическую формулу оксида, вычислим валентность мышьяка в оксиде по формуле
В = 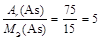 .
.
Следовательно, химическая формула оксида мышьяка As2O5 .
Пример 3. На восстановление 3,6 г оксида металла израсходовано 1,7 дм3 водорода при н.у. Найдите молярную эквивалентную массу металла.
Р е ш е н и е
1. По закону эквивалентов
МЭ(оксида) = 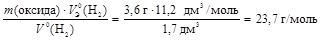 .
.
2. Так как МЭ(оксида) это сумма молярных эквивалентных масс металла и кислорода, то
МЭ(Ме) = МЭ(оксида) - МЭ(О) = 23,7 – 8 = 15,7 г/моль.
Пример 4.Из 3,31 г нитрата металла получено 2,78 г хлорида металла. Вычислите молярную эквивалентную массу оксида металла.
Р е ш е н и е
Закон эквивалентов в данном случае примет вид
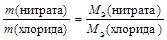 .
.
МЭ хлорида и нитрата металла можно представить таким образом
МЭ(нитрата) = МЭ(Ме) + МЭ(NO3-) ,
МЭ(хлорида) = МЭ(Ме) + МЭ(Cl-) .
Вычислим молярные эквивалентные массы ионов нитрата и хлорида
МЭ(NO3-) = 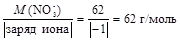 ,
,
МЭ(Cl-) = 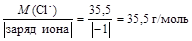 .
.
Тогда по закону эквивалентов
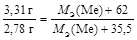 . Отсюда МЭ(Ме) = 104 г/моль,
. Отсюда МЭ(Ме) = 104 г/моль,
а молярная эквивалентная масса оксида металла равна
МЭ(оксида) = МЭ(Ме) + МЭ(О) = 104 + 8 = 112 г/моль.
Литература
1. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Мн.: Унiверсiтэцкае, 1996.
2. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Высш. шк., 1997.
3. Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии. М.: Высш. шк., 1990.
4. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991.
5. Коршунов Б.Г., Стефанюк С.Л. и др. Задачник по общей химии для металлургов. М.: Высш. шк., 1977.
6. Зайцев О.С. Познавательные задачи по общей химии. М.: Изд-во Моск. ун-та, 1982.
7. Михилев Л.А., Пассет Н.Ф., Федотова М.И. Задачи и упражнения по неорганической химии. СПб: Химия, 1995.
8. Кузьменко Н. Е., Еремин В.В. Сборник задач и упражнений по химии. М.: Издательский дом «ОНИКС 21 век», 2001.
9. Кузьменко Н. Е., Еремин В.В. Сборник конкурсных задач. М.: Издательский дом «ОНИКС 21 век», 2001.
10. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия, 1988.
Дата добавления: 2018-11-25; просмотров: 1149;
