Микрочастица, так же как и волна, не имеет одновременно точных значений координат положения в пространстве и импульса ее движения.
Математически принцип Гейзенберга отражается системой уравнений
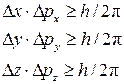 (3)
(3)
где 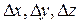 - погрешности определения координаты частицы по соответствующей оси;
- погрешности определения координаты частицы по соответствующей оси; 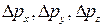 - погрешности определения проекций импульса на соответствующие оси.
- погрешности определения проекций импульса на соответствующие оси.
Из принципа Гейзенберга вытекает, что чем точнее определяется координата микрочастицы, тем неопределеннее становится информация о скорости ее движения, и наоборот.
Электрон в атоме существует в виде электронного облака – определенной области пространства, которая охватывает » 90 % заряда и массы электрона. Эту область пространства называют орбиталью. Состояние электрона в атоме принято описывать при помощи значений четырех квантовых чисел:
1. Главное квантовое число n характеризует основной запас энергии электрона и размер электронного облака. Оно может принимать только целочисленные значения от 1 до +¥. Чем больше значение n, тем больше размер электронного облака и выше его энергия. Электроны, имеющие одинаковые значения n, образуют электронные слои (иначе энергетические уровни), которые обозначают буквами
| Значение n | |||||||
| Уровень | K | L | M | N | O | Р | Q |
При n = 1 энергия электрона имеет минимальное значение Е1 = -13,6 эВ. Такое состояние электрона называется основным или нормальным. Состояния с n = 2, 3, 4… называются возбужденными. Энергии, соответствующие им, связаны с Е1 выражением
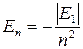 (4)
(4)
При переходе электрона с одного энергетического уровня на другой поглощается или испускается квант электромагнитной энергии DЕ
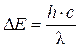 (5)
(5)
где с – скорость света (с = 3×108 м/с); с/l = n – частота излучения, с-1.
2. Орбитальное (иначе побочное) квантовое число l определяет момент количества движения электрона и характеризует форму электронного облака. l изменяется в пределах от 0 до (n – 1). Каждому значению l соответствует своя форма электронного облака: при l = 0 – сферическая; l = 1 – гантелевидная; l = 2 – две пересекающиеся под прямым углом гантели, l = 3 – три пересекающиеся под прямым углом гантели (см. табл.2)
Электроны одного энергетического уровня, имеющие одинаковые значения l, образуют энергетические подуровни, которые имеют буквенные обозначения (см. табл.2).
Состояние электрона с определенными значениями n и l записывают в виде сочетания цифрового значения n и буквенного l. Например, при n = 3 и l = 1 записывают 3p, а при n = 4 и l = 3 записывают 4f.
3. Магнитное квантовое число ml характеризует положение электронного облака в пространстве. ml изменяется в пределах от – l до + l, т.е. всего в каждом подуровне может принимать (2l + 1) значений, количество которых показывает число возможных положений электронного облака данного типа в пространстве. Все орбитали одного подуровня обладают одинаковой энергией и называются вырожденными.

 Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n, l и ml, называется атомной орбиталью (АО) и графически изображается в виде квадрата или в виде черты , которые называют энергетической ячейкой.
Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n, l и ml, называется атомной орбиталью (АО) и графически изображается в виде квадрата или в виде черты , которые называют энергетической ячейкой.
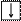
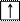 4. Спиновое квантовое число ms характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. ms может принимать только два значения ms = +½ ( ) и ms = – ½ ( ) .
4. Спиновое квантовое число ms характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. ms может принимать только два значения ms = +½ ( ) и ms = – ½ ( ) .
Таблица 2
Дата добавления: 2018-11-25; просмотров: 415;
