СТРОЕНИЕ АТОМОВ И СВОЙСТВА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Атом – электронейтральная микрочастица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядро атома содержит два типа частиц (нуклонов) – протоны и нейтроны. Число протонов в ядре определяет его заряд Z, который совпадает с порядковым номером элемента в периодической системе (ПС) Д.И. Менделеева.
Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, которое равно сумме числа протонов Z и числа нейтронов N:
А = Z + N , (14)
Атомы с одинаковыми значениями Z, но различными значениями А и N называются изотопами (например изотопы водорода: 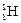 – протий,
– протий, 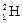 – дейтерий,
– дейтерий, 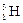 – тритий). Атомы, обладающие одинаковыми N, но различными Z и А, являются изотонами (например:
– тритий). Атомы, обладающие одинаковыми N, но различными Z и А, являются изотонами (например: 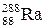 ,
, 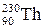 ,
, 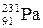 ). Если же атомы имеют одинаковые значения А, но различаются числами Z и N, то их называют изобарами (например:
). Если же атомы имеют одинаковые значения А, но различаются числами Z и N, то их называют изобарами (например: 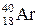 ,
, 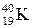 ,
, 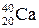 ).
).
Аr элемента, указываемая в ПС, является средней величиной массовых чисел его природных изотопов с учетом их распространенности в природе. Например, природный хлор состоит в основном из двух изотопов 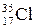 (75,43 % атом.) и
(75,43 % атом.) и 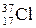 (24,57 % атом.), поэтому его атомная масса будет равна:
(24,57 % атом.), поэтому его атомная масса будет равна:
Ar(Cl) = 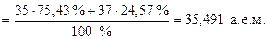
Современная теория строения атома основана на законах квантовой механики, согласно которым движущимся микрообъектам присуща двойственная природа: они являются частицами, но имеют волновой характер движения. Математически корпускулярно-волновой дуализм микрообъектов выражается уравнением де Бройля
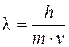 , (2)
, (2)
где l - длина волны, м; h – постоянная Планка (h = 6,63×10-34 Дж×с); m – масса микрочастицы, кг; v – скорость движения микрочастицы, м/с.
Из волновых свойств микрообъектов следует принцип неопределенности Гейзенберга:
Дата добавления: 2018-11-25; просмотров: 390;
